
Николай Ф. Бункин¹ ², Полина Н. Болоцкова¹ ², Елена В. Бондарчук³, Валерий Г. Грязнов³, Валерий А. Козлов¹ ², Мария А. Окунева¹ ², Олег В. Овчинников³, Никита В. Пенков⁴, Олег П. Смолий³, Игорь Ф. Турканов³
¹Московский государственный технический университет им. Н. Э. Баумана, 2-я Бауманская ул. 5, Москва 105005, Россия;
²Институт общей физики им. А.М. Прохорова РАН, ул. 38, Москва 119991, Россия
³«Концерн ГРАНИТ», Гоголевский бул., 31, корп. 2, Москва 119019, Россия;
⁴Федеральный исследовательский центр «Пущинский научный центр биологических исследований Российской академии наук», Институт биофизики клетки Российской академии наук, ул. 3, Пущино, Московская область 142290, Россия;
Статья опубликована в журнале Polymers (рейтинг — Q1) 7 августа 2021 года.
Ссылка на статью на английском

АННОТАЦИЯ
В экспериментах по фотолюминесцентной спектроскопии изучен режим взаимодействия полимерной мембраны Нафион с различными аминокислотами. Эксперименты проводились с физиологическими растворами NaCl, приготовленными на основе обычной воды (содержание дейтерия 157 ± 1 чнм), а также на основе воды, обедненной дейтерием (содержание дейтерия ≤ 1 чнм).
К проведению этих исследований авторов подтолкнул тот факт, что при набухании нафиона в обычной воде полимерные волокна эффективно «разматываются» в объем жидкости, в то время как в случае с водой, обедненной дейтерием, эффект разматывания отсутствует. Кроме того, полимерные волокна, размотанные в объем жидкости, схожи с внеклеточным матриксом (гликокаликсом) на поверхности клеточной мембраны. Интересно выяснить роль размотанных волокон во взаимодействии аминокислот с поверхностью полимерной мембраны. Оказалось, что при взаимодействии аминокислот с поверхностью мембраны возникают эффекты тушения люминесценции от центров люминесценции. Сначала мы наблюдали различные динамические режимы, возникающие при набухании мембраны нафиона в суспензии аминокислот с различным изотопным содержанием, включая триггерные эффекты, аналогичные процессам в логических элементах компьютеров.
1. ВВЕДЕНИЕ
Нафион® (подробнее см. обзор [1]) — ионный сополимер, состоящий из перфторуглеродного каркаса (аналогичного тефлону) и сшитых концевых сульфонатных групп. Нафион обладает высокой химической и термической стабильностью и активно изучается как матрица для водородных топливных элементов. В этом случае сульфонатные группы обладают гидрофильными свойствами, а перфторуглеродные цепи — гидрофобными. В безводном нафионе гидрофильные сульфонатные группы HSO₃ чаще всего собираются в округлые или стержневидные обратные мицеллы, погруженные в гидрофобную матрицу. Набухая в воде, нафион проявляет амфифильные свойства: при этом образуются различные структуры, состоящие из гидрофильных и гидрофобных сегментов. Эти структуры очень чувствительны к изменению концентрации воды внутри полимерной матрицы, что приводит к образованию цилиндрических мицелл в виде сквозных цилиндрических каналов. Из-за диссоциации сульфонатных групп, происходящей при набухании внутри этих каналов, полимерная матрица позволяет протонам проникать в эти каналы (что используется в водородной энергетике), но не позволяет анионам и неполярным молекулам, таким как O₂, проходить через них.
Отметим, что влияние увлажнения критично не только для полимерных матриц, но и для кристаллических многослойных мезопористых пленок, см., например, недавнюю работу [2]. На границе нафион-вода диссоциация концевых сульфонатных групп развивается по реакции R─SO₃H + H₂O↔R─SO₃− + H₃O⁺, т. е. протон перемещается в объем воды, а поверхность нафиона в воде проявляет кислотные свойства. В [3] распределение значения pH в водном слое вблизи границы раздела нафион измерялось как функция расстояния от поверхности мембраны; установлено, что в пределах 1 мм от поверхности мембраны pH ≈ 3. Кроме того, как показано в [4], мицеллы полимерных цепей ориентированы параллельно поверхности мембраны, если мембрана примыкает к газовой среде, тогда как если мембрана прилегает к воде, мицеллы ориентированы перпендикулярно поверхности мембраны. При набухании в воде объем гидрофильной фазы нафиона увеличивается, и обратные мицеллы соединяются друг с другом, образуя трехмерную сеть [5]. Объемная доля гидрофобной фазы уменьшается, и эта фаза распадается на отдельные мицеллы. Свойства нафиона зависят от различных примесей в системе. Например, в [6] показано, что добавление H₂S в количестве около 10 частей на миллиард к чистому водороду приводит к значительному снижению протонной проводимости через полимерную мембрану в водородном топливном элементе, т. е. к снижению эффективности топливного элемента.
При набухании нафиона в воде, у поверхности мембраны образуется участок особой структуры. Оказалось, что коллоидные частицы микронного размера эффективно выталкиваются из этой области; именно поэтому ее назвали «зоной отчуждения», см. монографию [7] и ссылки в ней. Зона отчуждения составляет около 200 мкм; этот результат был получен в экспериментах по оптической микроскопии. В то же время считается, что твердая поверхность способна модифицировать прилегающий слой воды только в пределах 1-2 нм; этот размер соответствует радиусу так называемых дисперсионных сил, см., например, [8]. Наиболее актуальную информацию об исследованиях зоны отчуждения, включая подробное обсуждение физических механизмов формирования этой структуры, можно найти в обзоре [9].
Как показано в наших работах [10–12], образование зоны отчуждения связано с эффектом «разматывания» полимерных волокон с поверхности мембраны в объем воды. Поскольку размотанные волокна полностью не отрываются от поверхности мембраны, эти волокна напоминают гликокаликсные (внеклеточный матрикс) -полисахаридные волокна на липидной двухслойной структуре клеточной мембраны (см., например, [13]). В этом случае формируется топологическая структура типа «жесткая щетка»; в [10] показано, что у поверхности мембраны эта структура подобна коллоидному кристаллу, образованному отрицательно заряженными стержнеобразными полимерными частицами. Кроме того, в [11,12] было показано, что площадь, занимаемая размотанным полимером, зависит от содержания дейтерия в воде. Фактически для обычной воды (содержание дейтерия 157 ± 1 чнм, см. [14]) размер этой области составляет около 200 мкм, что близко к размеру зоны отчуждения. В то же время для воды, обедненной дейтерием (DDW, содержание дейтерия ≤ 1 чнм), эффект разматывания отсутствует. В [12] была выдвинута гипотеза, что мембрана нафиона похожа на клеточную мембрану: и клеточная мембрана, и пластинка нафиона в воде окружены «щеткой» из полимерных волокон.
Поэтому представляет интерес изучение взаимодействия различных аминокислот с нафионом с учетом раскручивающего эффекта.
В этой связи следует отметить, что взаимодействие белков с мембраной нафион изучалось в основном в контексте инкапсуляции окислительно-восстановительных белков, таких как глюкозооксидаза, цитохромы, ферредоксин, и комплекса фотосистемы цианобактерий, см. [15]; свойства фотосистемы на основе нафиона подробно описаны в обзоре [16]. Было показано, что при контакте поверхности нафиона с суспензией белка макромолекулы белка не проникают в полимерную матрицу.
Чтобы получить инкапсулированные в матрицу белки, белковые пленки и полимерную мембрану обычно помещают в проводящие ячейки. В этом случае используются очень тонкие (до 1 мкм) пленки нафиона, так как проводимость полимера уменьшается с увеличением толщины пленки.
Большое количество работ посвящено инкапсуляции глюкозооксидазы внутрь нафиона; эти исследования открывают перспективы для создания высокочувствительных биоэлектрических сенсоров глюкозы, в том числе имплантируемых, что важно для пациентов с диабетом, см., например, [17].
Авторы настоящего исследования измерили активность положительно заряженного цитохрома и нейтрального цитохрома b5 и цитохрома c551, инкапсулированных в мембрану нафион; было обнаружено, что у нейтральных белков сохраняется окислительно-восстановительная активность, тогда как положительно заряженный цитохром теряет окислительно-восстановительную активность. Взаимодействие нафиона с кровью человека, окислительно-восстановительными белками тканевой жидкости, такими как альбумин, фибриноген, фибронектин, и неразбавленной сывороткой крови, изучалось в [18,19].
Также было исследовано взаимодействие различных бактерий с поверхностью нафиона с учетом образования зоны отчуждения. В этой связи уместно отметить недавнюю работу [20], где в эксперименте на основе флуориметрии было показано, что различные бактерии в обычной водной суспензии эффективно отталкиваются от поверхности нафиона на расстояние, примерно равное размеру зоны отчуждения.
Дополнительным мотивом проведения нашего исследования является тот факт, что, насколько нам известно, логический двоичный элемент был реализован на основе аминокислот. Недавно была описана система [21], включающая металлоорганическую кристаллическую матрицу, в которую введены ионы трехвалентного тербия, ионы двухвалентной меди и аспарагиновая кислота. Оказалось, что ионы трехвалентного тербия являются эффективным флуорофором, а ионы двухвалентной меди служат гасителем люминесценции этого флуорофора.
В то же время аспарагиновая кислота образует комплекс с ионом меди, который нейтрализует функцию тушения люминесценции этого иона, т.е. люминесценция Tb3+ эффективно восстанавливается. Эта работа демонстрирует, что высокий уровень люминесценции (например, в отсутствие иона Cu²⁺ или в присутствии как иона Cu²⁺, так и аспарагиновой кислоты) можно условно рассматривать как «1» логического двоичного элемента, в то время как низкий уровень люминесценции в присутствии ионов меди без аспарагиновой кислоты условно можно принять за «0» двоичного элемента. Поскольку наша экспериментальная методика основана на возбуждении люминесценции с поверхности нафиона (см. ниже), нас интересуют эффекты тушения/восстановления люминесценции аминокислотами в системе с нафионом, т. е. возможность реализации логического двоичного элемента на основе мембраны нафион, погруженной в суспензию аминокислот.
Обобщая, нам не известны работы, в которых изучались бы особенности взаимодействия аминокислот с поверхностью мембраны нафион в условиях раскручивания полимерных волокон. Особый интерес представляет исследование этого взаимодействия при отсутствии эффекта раскручивания (в этом случае суспензии аминокислот должны быть приготовлены на основе DDW). В заключение этого раздела следует напомнить, что в воде у поверхности Нафиона образуется кислая среда с pH ~ 3; это следует учитывать в экспериментах.
2. МАТЕРИАЛЫ И МЕТОДЫ
Для проведения экспериментов с фотолюминесцентной спектроскопией нафиона в аминокислотных суспензиях была разработана экспериментальная установка, изображенная на рисунке 1 (см. [10,22]).
Экспериментальная установка включает в себя диодный лазер непрерывного действия (1) с длиной волны λ = 369 нм, спектрометр (6) со спектральным диапазоном 240-1000 нм и разрешением 2 нм, многомодовое оптоволокно (2) с диаметром сердцевины 50 мкм, передающее лазерное излучение (1) в кювету (3) с жидким образцом, и аналогичное оптическое волокно (5), через которое сигнал люминесценции передавался на вход спектрометра.
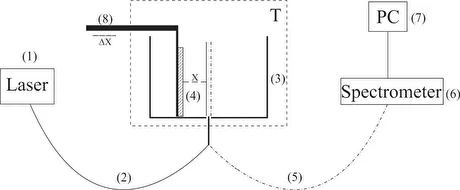
Рисунок 1. Схема экспериментальной установки. (1) лазер, (2), (5) многомодовое оптическое волокно, (3) кювета с жидким образцом, (4) пластина нафиона, (6) спектрометр, (7) компьютер, (8) столик с микрометрической горизонтальной подачей для выравнивания пластины нафиона относительно оптической оси, (T) термостат.
Следует избегать попадания достаточно интенсивного лазерного излучения на вход спектрометра (6). Волокно (5) было оснащено рефокусировщиком и светофильтром, отсекающим излучение в диапазоне λ <350 нм (не показано на рисунке 1). Спектры обрабатывались на персональном компьютере (7). Цилиндрическая кювета (3) была изготовлена из тефлона и имела радиус 2 см. Пластина нафиона (4) закреплялась на столике (8) с микрометрической горизонтальной подачей. Такая подача использовалась для точного расположения пластины нафиона по оптической оси; оптическая ось совпадала с геометрической осью цилиндрической кюветы, т.е. пластина нафиона облучалась лазером в геометрии скользящего падения. Мы использовали пластины NafionN117 (SigmaAldrich, Сент-Луис, Миссури, США) толщиной L₀ = 175 мкм и площадью 1 × 1 см².Излучение лазерного диода стимулировало люминесценцию пластины нафиона в спектральном диапазоне 400-600 нм. В нашей предыдущей работе [11] было показано, что центрами люминесценции являются конечные сульфонатные группы.
Как показано в [4], при погружении пластины нафиона в воду поверхностные пучки полимерных волокон имеют тенденцию ориентироваться перпендикулярно поверхности, т.е. концевые сульфонатные группы расположены в основном на границе раздела полимер-вода. Поэтому в наших экспериментах люминесценция возбуждалась в геометрии скользящего падения излучения накачки.
Поскольку нафион прозрачен для излучения в видимом диапазоне, люминесцентное излучение, отраженное от цилиндрической стенки кюветы, концентрировалось вдоль оптической оси (5), а затем поступало на вход спектрометра (6). В отсутствие нафиона люминесценция в изотонических растворах, приготовленных на основе обычной воды/DDW, а также в суспензиях аминокислот на основе обоих растворов в этом спектральном диапазоне не обнаруживалась. Это было специально подтверждено в экспериментах.
Перед проведением эксперимента измеряли спектр люминесценции сухого нафиона; при измерении этого спектра кювета не заполнялась жидким образцом. С помощью микрометрического винта столика (8) пластину нафиона ориентировали таким образом, чтобы сигнал люминесценции в максимуме спектра (460 нм) достиг максимального значения; это соответствует оптимальной ориентации пластины вдоль оптической оси. Затем в кювету наливали тестовый образец; момент заполнения кюветы соответствует начальной точке времени набухания нафиона.
Изученными аминокислотами были глицин, аланин, гистидин, лизин, а также аспарагиновая и глутаминовая кислоты, производства SigmaAldrich, Сент-Луис, Миссури, США. Для приготовления солевых растворов использовали NaClЧДА (SigmaAldrich, Сент-Луис, Миссури, США). В качестве растворителя использовалась деионизированная вода (содержание дейтерия 157 ± 1 чнм) с удельным сопротивлением 18 МОм × см при 25°C, очищенная с помощью аппарата Milli-Q. Также для приготовления солевых растворов NaCl использовали DDW (содержание дейтерия ≤ 1 чнм), ппроизводства SigmaAldrich, Сент-Луис, Миссури, США.
Для определения размеров исследуемых аминокислот и значений их дзета-потенциала были проведены эксперименты по динамическому рассеянию света (ДРС) с помощью системы ZetasizerNanoZS (Малверн, Великобритания), оснащенной гелий-неоновым лазером непрерывного действия на длине волны λ = 633 нм (максимальная мощность 4 мВт) и терморегулятор; угол рассеяния составлял 173° (методика динамического светорассеяния подробно описана в монографиях [23,24]). В наших экспериментах соляная кислота (SigmaAldrich, Сент-Луис, Миссури, США) добавлялась к суспензии аминокислот для достижения значения pH = 3. Как уже отмечалось, это было необходимо для создания условий, близких к тем, которые реализованы на границе раздела нафиона и воды. Чтобы исключить влияние агрегатов аминокислот и газовых нанопузырьков, суспензии предварительно фильтровали через фильтр с порами 200 нм производства TPP (Trasadingen, Швейцария); такая методика применялась в наших недавних экспериментах [25,26].
Мы также исследовали фотолюминесценцию коллоидной водной суспензии частиц нафиона. Для этого лист нафиона толщиной 175 мкм растирали в порошок коллоидных частиц со средним размером частиц 12 мкм (этот размер измеряли с помощью оптического микроскопа) с помощью коллоидной мельницы (производства ООО «Командарм», Новосибирск, Россия).
В заключение этого раздела имеет смысл дать несколько комментариев по измеренному нами сигналу люминесценции. Поскольку при набухании нафиона молекулы воды проникают в полимерную матрицу, поверхностная плотность сульфонатных групп должна уменьшаться. Интенсивность I (t) сигнала люминесценции в спектральном максимуме (λ = 460 нм), где t — время набухания, описывается формулой (см., например, [10])
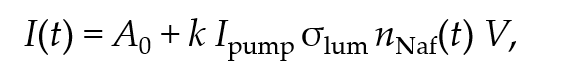
где I pump — интенсивность накачки, nNaf — объемная плотность центров люминесценции (в нашем случае это плотность сульфонатных групп), σ lum — сечение люминесценции, A₀~20-270 п.е. соответствует спектральному шуму спектрометра (этот шум, очевидно, включает в себя рассеянный свет), k — размерный коэффициент, который определяется чувствительностью спектрометра, V — объем люминесценции. Очевидно, что при условии σ lum = const (отсутствуют эффекты тушения/усиления люминесценции при облучении сульфонатных групп излучением накачки) интенсивность люминесценции I (t) полностью определяется плотностью nNaf(t), которая экспоненциально уменьшается при набухании (см. нашу недавнюю работу [22]). В этом случае экспериментальные кривые I (t) можно аппроксимировать экспоненциальными функциями.
Представленные ниже экспериментальные зависимости соответствуют усреднению по 5 последовательным измерениям; столбцы на рисунках показывают доверительные интервалы.
3. ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
На рис. 2 представлены зависимости интенсивности люминесценции I (t) в спектральном максимуме от времени пропитывания в обычной воде и DDW в отсутствие NaCl и аминокислот; видно, что зависимости хорошо аппроксимируются убывающими экспоненциальными функциями, а свободные константы, предэкспоненциальные множители и времена релаксации одинаковы для обеих жидкостей.
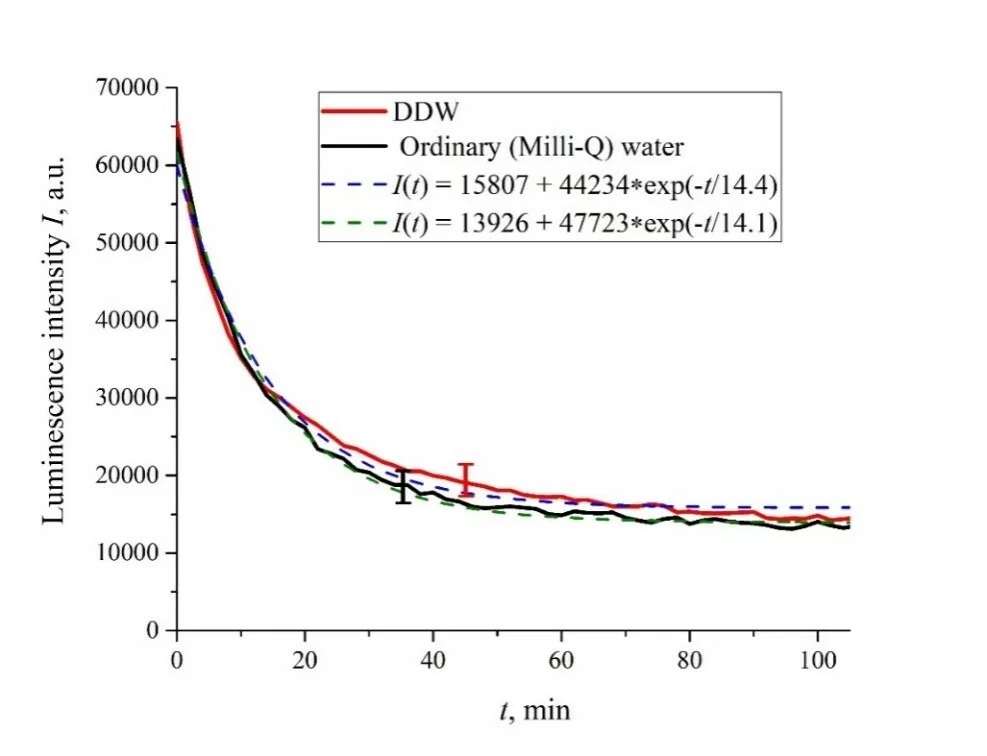
Рисунок 2. Интенсивность люминесценции I(t) в зависимости от времени пропитывания в обычной воде и DDW в отсутствие NaCl и аминокислот.
Исследуемые аминокислоты были охарактеризованы в экспериментах по ДРС при pH = 3. Массовая концентрация всех аминокислот в этих экспериментах составляла 20 г/л; такая высокая концентрация аминокислот в этом эксперименте объясняется очень малым сечением рассеяния частиц, размер которых составляет порядка нескольких ангстрем.
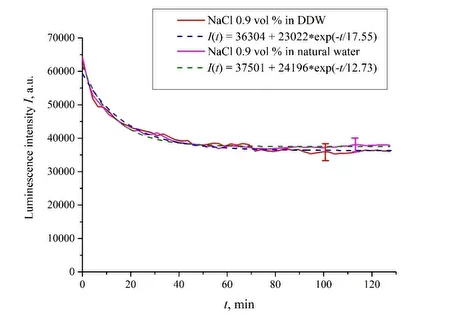
Рисунок 3. Интенсивность люминесценции I(t) в зависимости от времени пропитывания в физиологических растворах на основе обычной воды и на основе DDW (0,9 об.% NaCl) в отсутствие аминокислот.
Для каждой суспензии аминокислот предварительно измеряли коэффициент динамической вязкости. Для каждой аминокислоты было выполнено 5 последовательных измерений; найдены средние значения ζ-потенциалов и гидродинамических диаметров.
Обратите внимание, что все жидкие образцы были предварительно профильтрованы на пористой мембране 200 нм, чтобы снизить агрегацию аминокислот и исключить влияние фазы нанопузырьков (согласно [25,26], диаметр газовых нанопузырьков составляет ~ 300 нм, т. е. такие частицы следует удалять фильтрацией). Гидродинамический радиус R и ζ-потенциал jописываются формулой:

где q — величина заряда, ε — диэлектрическая проницаемость воды, ε = 80, (1/4πε₀) = 9 × 10⁻⁹ м/Ф. По уравнению (2) рассчитывали заряд q для каждой аминокислоты. В экспериментах по ДРС нам не удалось измерить значения R и ϕ для суспензии глицина. На рис. 4а, б представлены гистограммы зависимости интенсивности ДРС от гидродинамических диаметров рассеивателей; чтобы не перегружать рисунок, мы приводим данные только для лизина (панель (а)) и глутаминовой кислоты (панель (б)).
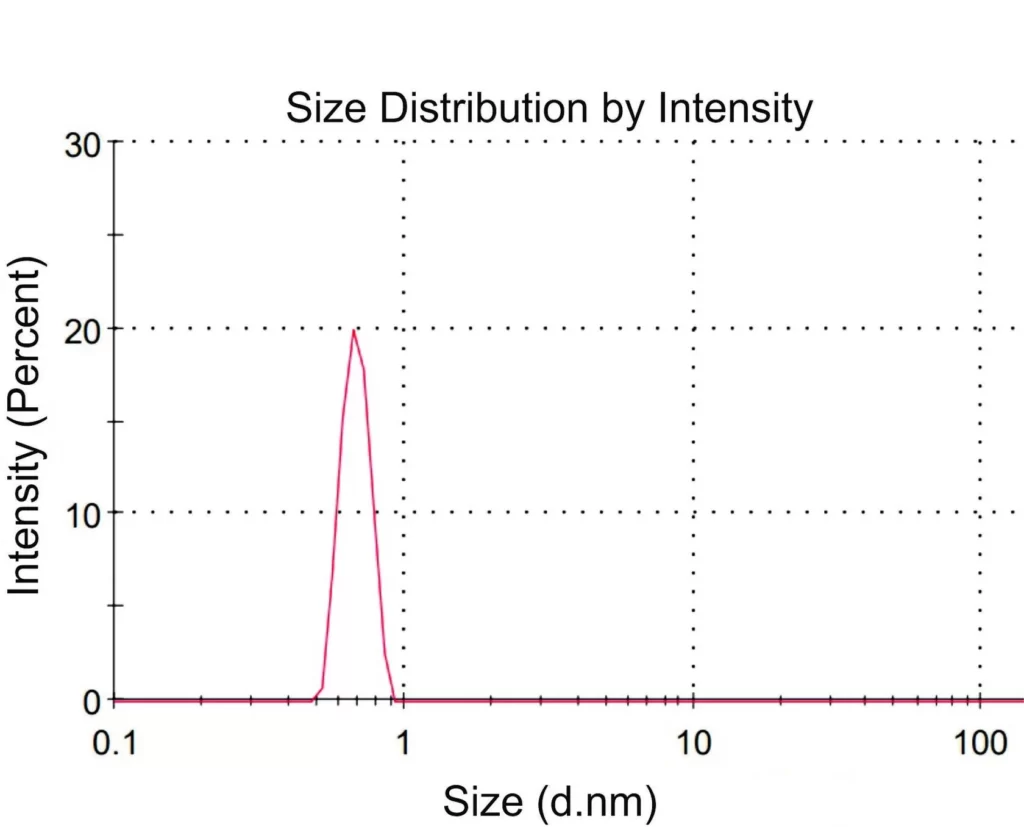
4а
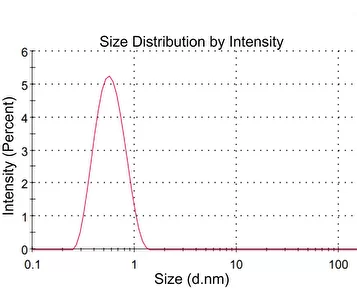
Рисунок 4. Распределение интенсивности ДРС по диаметрам частиц в суспензиях аминокислот при угле рассеяния 173°: а — лизин, б — глутаминовая кислота.
В таблице 1 показаны результаты эксперимента по динамическому светорассеянию; также приведены литературные данные о размерах и значениях pH в изоэлектрической точке (pI) исследуемых аминокислот.
| Диаметр (Å), Литературные данные | Диаметр (Å), Измеренные показатели | Заряд (10²⁰ Q) | pI (31) | |
|---|---|---|---|---|
| Лизин | 5.7 [28], 8.02 [30] | 6.87 ± 1.0 | 1.59 | 9.8 |
| Гистидин | 5.5 [27], 8.9 [30] | 4.52 ± 1.0 | −0.837 | 7.6 |
| Глицин | 4.2 [27], 5.1 [30] | — | — | — |
| Аланин | 4.7 [29], 4.6 [30] | 6.78 ± 1.0 | −0.063 | 6.01 |
| Аспарагиновая кислота | 5.0 [27], 7.44 [30] | 7.1 ± 1.0 | −0.55 | 3.0 |
| Глутаминовая кислота | 5.3 [27], 7.98 [30] | 5.98 ± 3.0 | −0.52 | 3.2 |
Как следует из данных табл. 1, величина заряда для всех аминокислот меньше заряда электрона (e = −1.6 × 10⁻¹⁹ Q), что, очевидно, связано с экранированием ионами, растворенными в жидкости. Отметим, что согласно данным [31] изоэлектрические точки для глутаминовой и аспарагиновой кислот соответствуют pI = 3,2 и 3,0 соответственно, а для лизина изоэлектрическая точка pI = 9,8. Следовательно, глутаминовая и аспарагиновая кислоты при pH = 3 действительно близки к изоэлектрической точке, в то время как лизин находится далеко от изоэлектрической точки и должен быть положительно заряжен.
Таким образом, наши экспериментальные результаты в основном не противоречат литературным данным. Противоречие с данными [31] было получено для гистидина и аланина: согласно [31] изоэлектрические точки для гистидина и аланина равны pI = 7,6 и 6,01 соответственно, т. е. при pH = 3 эти аминокислоты должны иметь положительный заряд, а наши результаты показывают, что они слабоотрицательные.
По-видимому, для более точного измерения ζ-потенциала частиц размером с Ангстрем необходимы более точные эксперименты; насколько нам известно, никто еще не определил значения заряда аминокислот путем измерения дзета-потенциала с помощью системы ZetasizerNanoZS. В основном, чтобы измерить знак заряда аминокислоты при фиксированном значении pH, используются очень разные экспериментальные методы, см. [31].
Перед проведением экспериментов с суспензиями аминокислот необходимо было убедиться, что, во-первых, фотолюминесценция аминокислот в наших экспериментах не стимулируется. Для этого суспензии аминокислот с массовой концентрацией 1 г/л были приготовлены в физрастворе на основе обычной воды (0,9 об. % NaCl) при pH = 5,5 (в этих экспериментах к жидким образцам не добавляли HCl кислоту) и залиты в ковету (3) на рисунке 1; пластина нафиона в этих экспериментах не использовалась. Оказалось, что люминесценция аминокислот не возбуждается лазерным излучением с длиной волны λ = 369 нм; подробнее о спектральных характеристиках фотолюминесценции аминокислот см. монографию [32].
Кроме того, необходимо было убедиться, что существуют (или, наоборот, не существуют) эффекты тушения/усиления люминесценции аминокислотами (механизмы тушения люминесценции описаны в [33]). Действительно, если поперечное сечение люминесценции σ lum непостоянно, зависимость I(t) будет более сложной, чем показано на рисунках 2 и 3.
Пластина нафиона сначала была измельчена в порошок с помощью коллоидной мельницы; средний размер частиц нафиона составлял ~ 12 мкм (что контролировалось с помощью оптического микроскопа). Затем коллоидные частицы растворяли в физрастворе 0,9 об. % NaClна основе обычной воды с pH = 3 (это значение было достигнуто добавлением HCl кислоты, SigmaAldrich, Сент-Луис, Миссури, США).
Как следует из графиков на рисунке 5, перед добавлением аминокислот в раствор частиц нафиона уровень люминесценции был примерно таким же и определялся концентрацией частиц нафиона (для улучшения качества представления использовались растворы с несколько разными концентрациями частиц нафиона). Затем на 20-й минуте суспензию аминокислот концентрацией 1 г/л, приготовленную в физрастворе 0,9 об. % NaClна основе обычной воды, добавляли к коллоидной смеси частиц нафиона; объемы коллоидной смеси и суспензии аминокислот были одинаковыми.
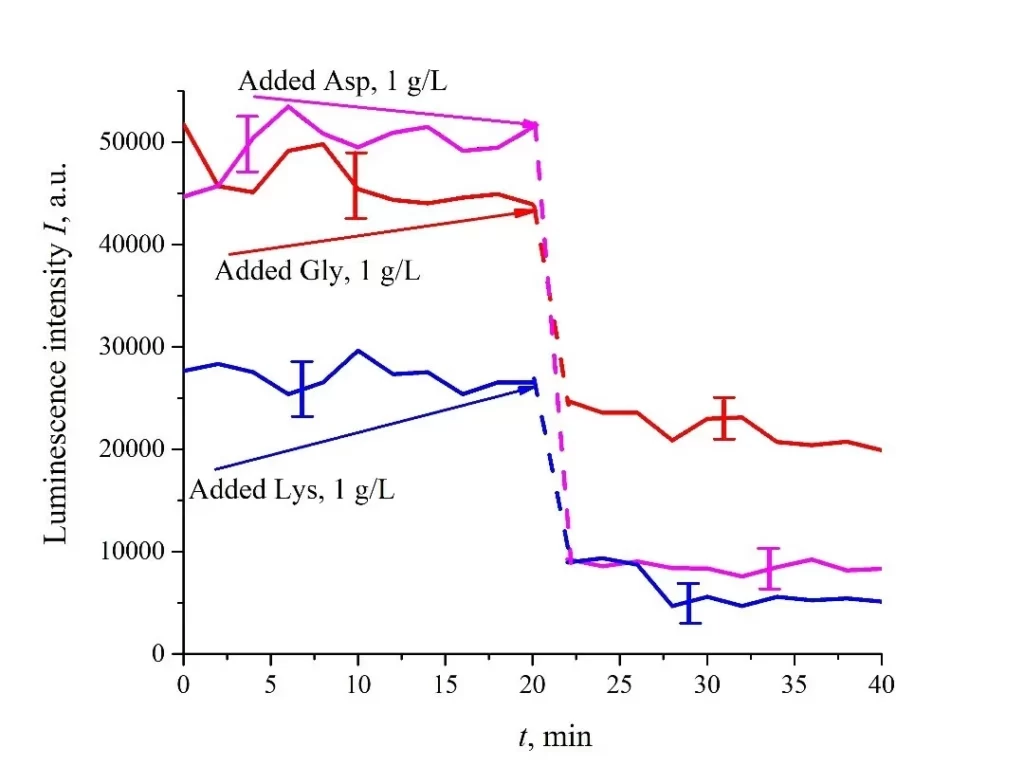
Рисунок 5. Зависимость интенсивности люминесценции коллоидной смеси частиц нафиона при добавлении суспензии аминокислот (20-я минута). Приведены зависимости для аспарагиновой кислоты, глицина и лизина с концентрацией 1 г/л.
Это привело к резкому уменьшению люминесценции, т.е. возникло тушение. Эффект тушения люминесценции наблюдался для всех изученных аминокислот (чтобы не загромождать рисунок 5, мы приводим зависимости только для аспарагиновой кислоты, глицина и лизина).
Как известно, тушение люминесценции — очень быстрый процесс, см. [33]. В нашем случае тушение развивается в течение 1-2 мин, что связано с процессами смешивания аминокислот и частиц нафиона. Как следует из зависимостей на рисунке 5, после добавления суспензии аминокислот и завершения процессов перемешивания уровень люминесценции снова достигает исходного уровня. Таким образом, продолжительность этого эксперимента не имела решающего значения; продолжительность эксперимента составила 40 мин.
На рисунках 6a – f представлены зависимости I(t) для суспензий различных аминокислот, приготовленных в солевых растворах 0,9 об. % NaCl на основе обычной воды и на основе DDW. Зависимость I(t) хорошо аппроксимируется двумя экспоненциальными функциями, что свидетельствует о наличии как минимум двух динамических режимов.
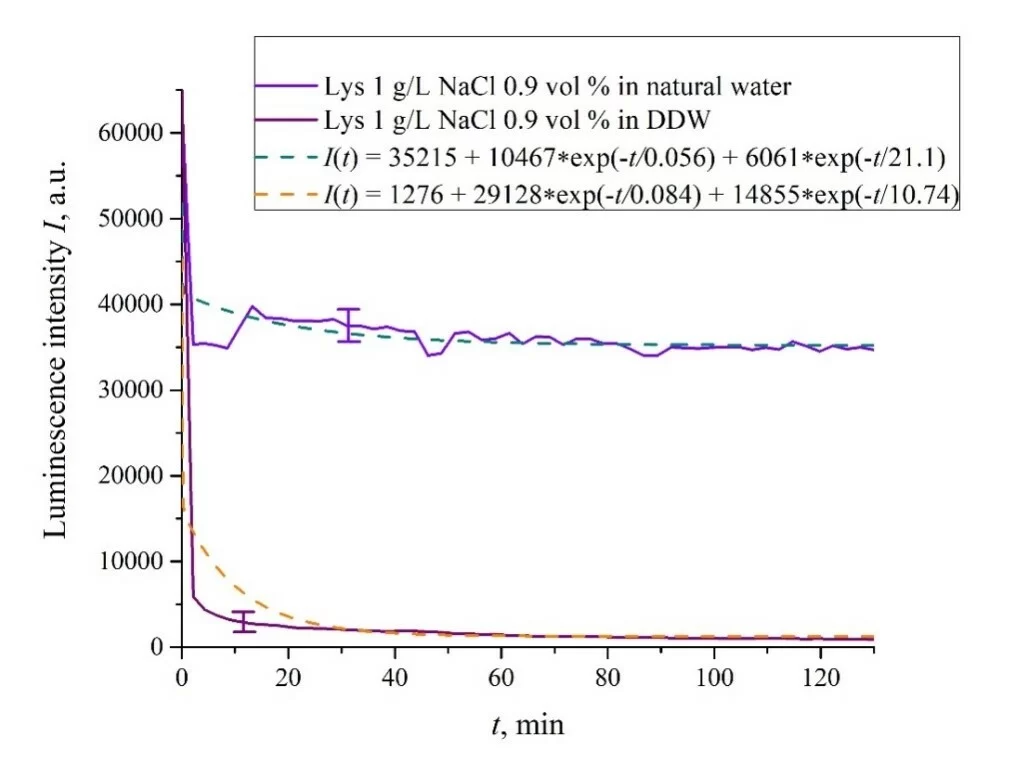
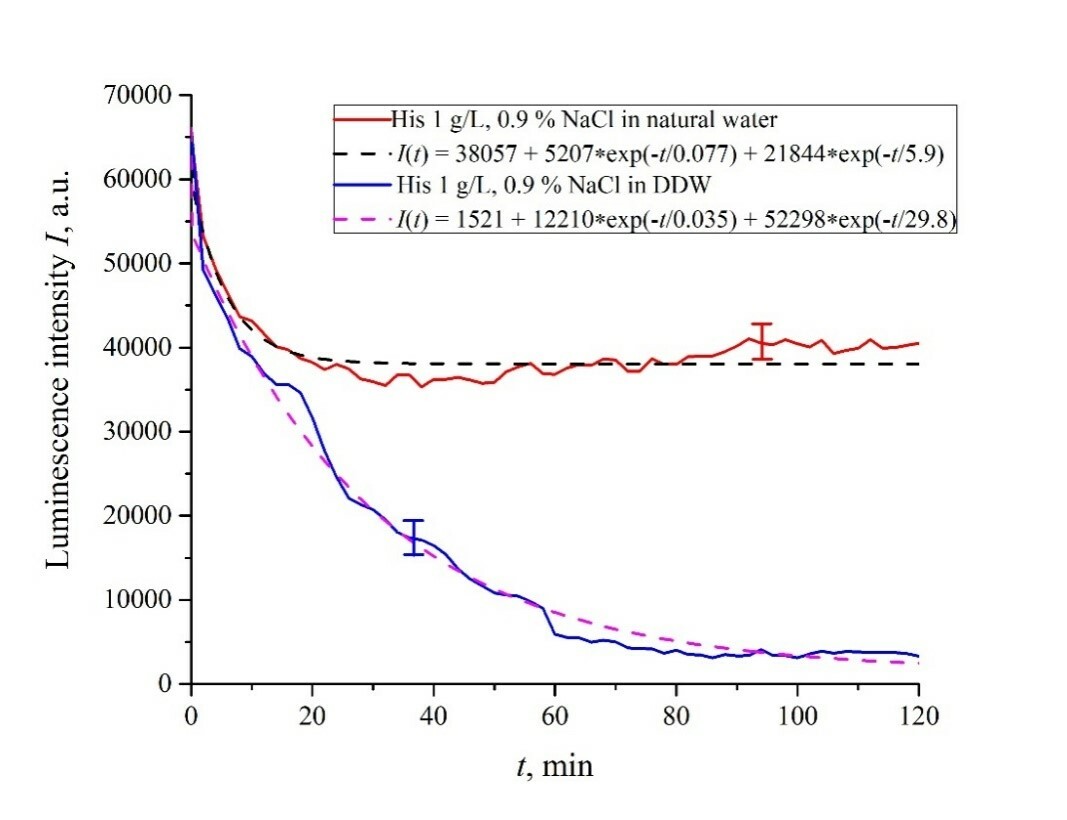
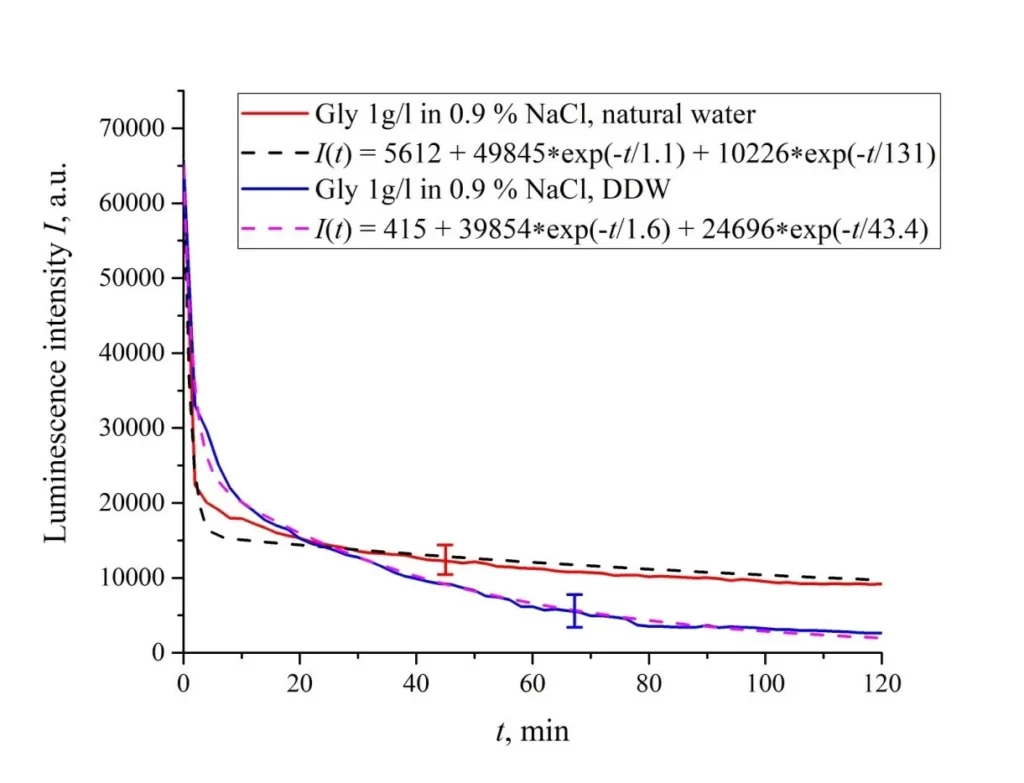
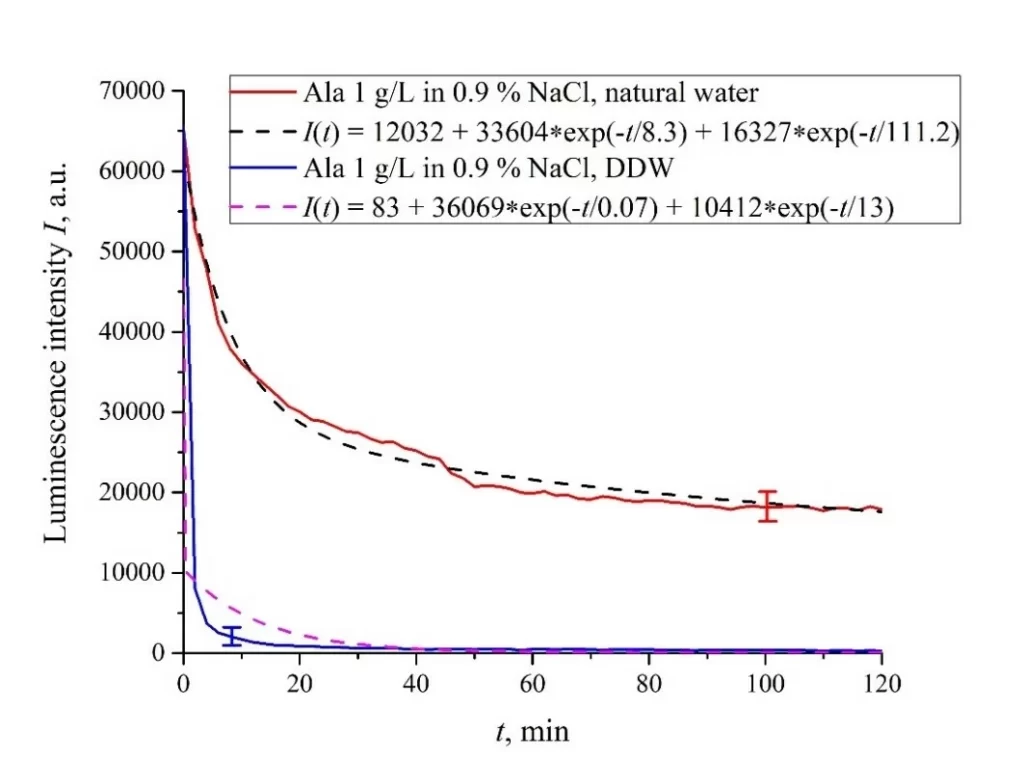
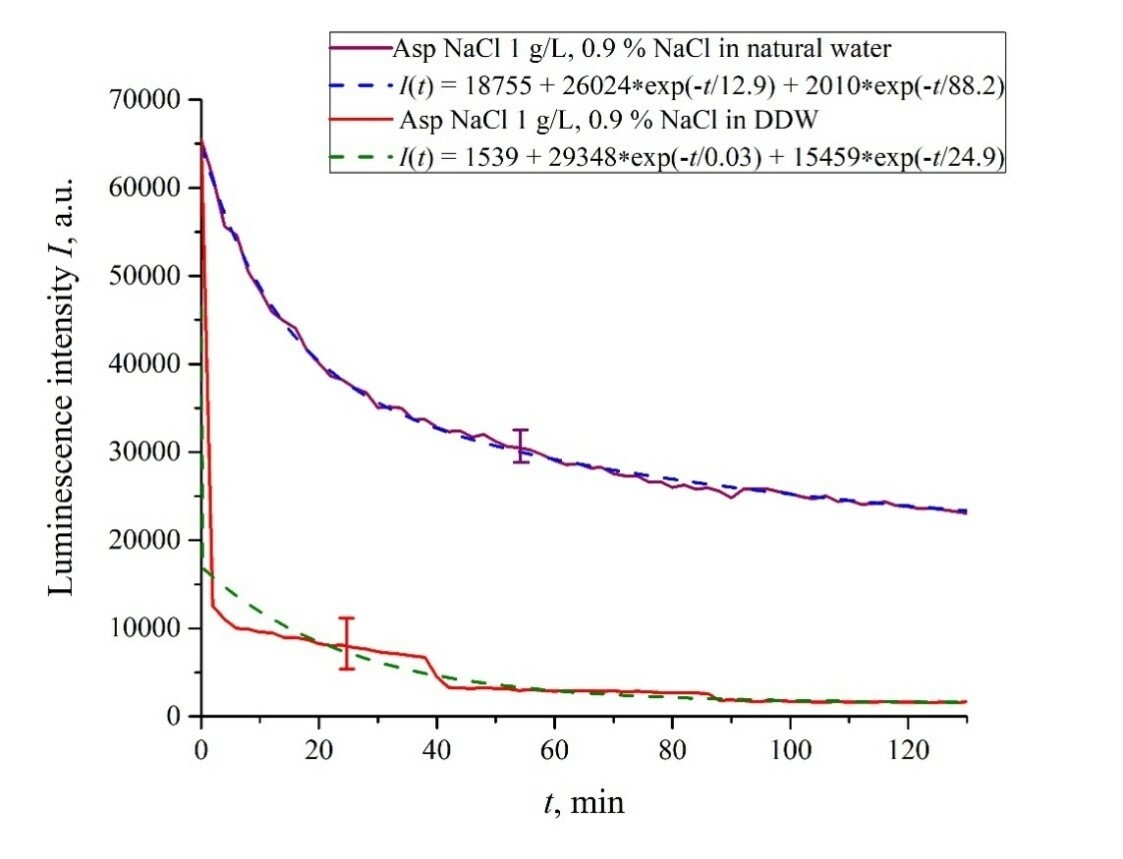
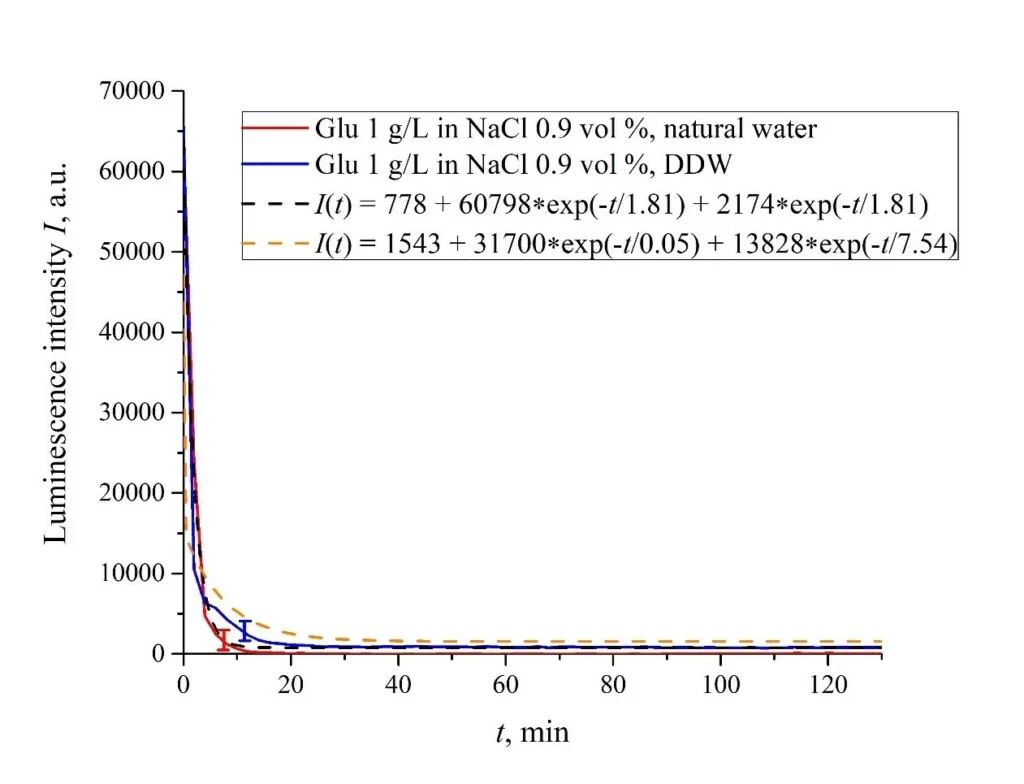
Рисунок 6. Интенсивность люминесценции I(t) в зависимости от времени выдержки в солевых растворах (0,9 об.% NaCl) на основе обычной воды и на основе DDW для следующих аминокислотных суспензий: а) лизин; (б) гистидин; (c) глицин; d) аланин; е) аспарагиновая кислота; (f) глутаминовая кислота.
Рассмотрим сначала зависимости, относящиеся к суспензиям на основе обычной воды (присутствует эффект разматывания полимерных волокон). Согласно нашей модели, сначала происходит тушение люминесценции, что сопровождается резким уменьшением интенсивности люминесценции (постоянные времени тушения люминесценции очень малы, см. [33]). За тушением следует более медленный процесс, связанный с разматыванием полимерных волокон и набуханием нафиона.
В таблице 2 приведены значения скоростей (в п.е.) убывания интенсивности люминесценции в е = 2,781828 раз (так называемое число Эйлера) для первой (v1) и второй (v2) экспонент, а также значения A свободной константы (в п.е.) для всех аминокислот в солевом растворе (0,9 об.% NaCl) на основе обычной воды. Без потери обобщенности, в случае суспензии на основе DDW зависимость I(t) также аппроксимируется двумя убывающими экспоненциальными функциями. Показатели v1, v2 и значения A свободных констант для суспензий, приготовленных в физиологическом растворе 0,9 об. % NaCl на основе DDW собраны в таблице 3. Следует отметить, что оценки v1 очень приблизительны, поскольку наша экспериментальная установка не предназначена для измерения таких высоких скоростей.
| v₁ , п.е. | v₂ , п.е. | А, п.е | |
| Лизин | 10,467/(0.056 × 2.78) = 678,186 | 6061/(21.1 × 2.78) = 103 | 35,215 |
| Гистидин | 5207/(0.077 × 2.78) = 24,307 | 21,844/(5.9 × 2.78) = 1330 | 38,057 |
| Глицин | 49,845/(1.1 × 2.78) = 16,288 | 10,226/(131 × 2.78) = 28 | 5612 |
| Аланин | 33,604/(8.3 × 2.78) = 1455 | 16,327/(111 × 2.78) = 53 | 12,032 |
| Аспарагиновая кислота | 26,024/(13 × 2.78) = 725 | 2010/(88.2 × 2.78) = 8.2 | 18,755 |
| Глутаминовая кислота | 60,798/(1.81 × 2.78) = 437,081 | 2174/(1.81 × 2.78) = 432 | 778 |
| v₁ , п.е. | v₂ , п.е. | А, п.е | |
| Лизин | 29,128/(0.084 × 2.78) = 124,644 | 14,855/(10.7 × 2.78)= 497 | 1276 |
| Гистидин | 5207/(0.035 × 2.78) = 125,398 | 52,298/(29.8 × 2.78) = 631 | 1521 |
| Глицин | 39,854/(1.6 × 2.78) = 8953 | 24,696/(43.4 × 2.78) = 205 | 415 |
| Аланин | 36,069/(0.07 × 2.78) = 185,216 | 10,412/(13 × 2.78) = 288 | 83 |
| Аспарагиновая кислота | 29,348/(0.03 × 2.78) = 351,642 | 15,459/(24.9 × 2.78) = 223 | 1539 |
| Глутаминовая кислота | 31,700/(0.05 × 2.78) = 227,894 | 13,828/(7.54 × 2.78) = 659 | 1543 |
4. ОБСУЖДЕНИЕ
В отсутствие аминокислот мы имеем дело только с одним показателем релаксации, см. Рисунки 2 и 3. Для обычной воды/DDW мы имеем для скоростей затухания v = 47,723/(14,1 × 2,782) = 1217 п.е. и v = 44 234/(14,4 × 2,782) = 1104 п.е. соответственно, см. рис. 2. Для физиологических растворов (0,9 об.% NaCl) на основе обычной воды/на основе DDW мы имеем, соответственно, v = 24 196/(12,73 × 2,782) = 683 п.е. и v = 23022/(17,55 × 2,782) = 472 п.е. соответственно, см. рис. 3. Как показано в [22], эти скорости связаны с релаксационным процессом уменьшения поверхностной плотности сульфонатных групп (центров люминесценции) при набухании. Уменьшение скорости набухания в физиологическом растворе по сравнению с чистой водой связано с образованием нанопузырьков на поверхности мембраны в присутствии ионов, см. [12]; эти нанопузырьки эффективно образуются в растворах электролитов (см. [25,26]) и, по-видимому, предотвращают набухание мембраны.
Как видно из таблиц 2 и 3, для суспензий аминокислот на основе обычной воды соотношение v1/v2 колеблется от 6584 (лизин) до 18 (гистидин), а для суспензий аминокислот, приготовленных на основе DDW, это соотношение составляет от 643 (аланин) до 43 (глицин). Таким образом, отношения скоростей v1/v2 для суспензий на основе обычной воды/DDW находятся примерно в одном диапазоне. Поэтому скорости затухания v1 и v2 не являются ключевым параметром, характеризующим различия в поведении аминокислот в обычной воде и DDW.
Для обоих типов суспензий аминокислот первая экспонента связана с тушением люминесценции как очень быстрым процессом, см. [33]. Вторая экспонента соответствует более медленному процессу релаксации, который проявляется после завершения тушения люминесценции. Для суспензий, приготовленных на основе DDW, свободные константы (интенсивности люминесценции I(t) при t → ∞) находятся в диапазоне 83 <A <1543 п. ед., в то время как для суспензий, приготовленных на основе обычной воды, свободные константы находятся в пределах 5612 <A <38 057 п. u .; напомним, что начальный (при t = 0) уровень люминесценции соответствует 65000 п. u. Можно сказать, что единственное качественное различие между поведением графиков I(t) для суспензий аминокислот, приготовленных на основе обычной воды и DDW, заключается именно в значениях свободных констант.
Таким образом, можно утверждать, что процесс тушения, описываемый первой экспонентой, эффективно прерывается для суспензий в обычной воде, а для суспензий на основе DDW процесс тушения завершается (уровень люминесценции снижается в 40-800 раз по сравнению с исходным уровень). Это можно объяснить эффектом разматывания полимерных волокон в объем солевого раствора на основе обычной воды; в солевых растворах на основе DDW этот эффект отсутствует. Силы притяжения, возникающие между размотанными полимерными волокнами в объеме воды, возникают за счет дополнительной свободной энергии:
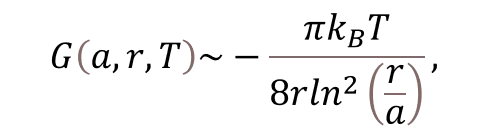
где r — расстояние между параллельными цилиндрами на единицу длины, a — ширина цилиндров, kB — постоянная Больцмана, подробнее см. [34]. Это взаимодействие возникает из-за корреляций в колебаниях заряда и приводит к образованию неаддитивных очень дальнодействующих сил, в которых притягивающим кооперативным взаимодействиям многих тел противодействуют отталкивающие электростатические силы двойного слоя между тонкими волокнами. Как было показано в [10], сочетание электростатических сил отталкивания и сил притяжения приводит к формированию упорядоченной пространственной структуры волокон нафиона вблизи поверхности полимера. Эту структуру можно рассматривать как особый тип коллоидного кристалла, который был подтвержден экспериментами по двулучепреломлению, см. [10].
Нам неизвестны шкалы r и a; однако мы можем использовать данные [4]. В данной работе, в частности, с помощью атомно-силовой микроскопии исследовалась граница раздела нафион – вода, и было обнаружено, что полимерные волокна в воде у поверхности мембраны преимущественно ориентированы перпендикулярно поверхности, а характерный масштаб приповерхностной неоднородности составляет около 1,85 нм (см. рис. 6б в [4]). Этот размер должен быть близок к диаметру размотанных полимерных волокон a. Предполагая, что r ≈ a, сила притяжения между полимерными волокнами будет очень большой из-за логарифмического члена в знаменателе.
Дальнейший анализ требует учета взаимодействия между размотанными полимерными волокнами и аминокислотами, находящимися в промежутках между волокнами. Этот анализ должен быть основан на квантово-химическом описании этого взаимодействия. В настоящее время мы разрабатываем соответствующую теоретическую модель. Однако можно предположить, что аминокислоты захватываются между размотанными полимерными волокнами, образуя дополнительную плотную оболочку, которая блокирует доступ аминокислот к поверхности мембраны, и поэтому тушение прекращается.
Действительно, мы использовали геометрию скользящего падения лазерного излучения на поверхность мембраны, тогда как эта дополнительная оболочка, по-видимому, формируется на расстоянии около 300 мкм от поверхности мембраны (размер зоны отчуждения см. в монографии [7] и наших работах [10,11]). Напомним, что в [20] было показано, что бактерии эффективно отталкиваются от поверхности нафиона именно на этом расстоянии.
Этот результат лишний раз доказывает, что полимерные волокна, размотанные в объеме жидкости, действительно выполняют функцию гликокаликса, то есть препятствуют проникновению различных инородных частиц в мембрану.
На основании сравнения результатов для обычной воды и физиологического раствора на основе обычной воды без аминокислот (рис. 2 и 3) и для суспензий аминокислот, приготовленных в физиологическом растворе на основе обычной воды, можно сделать вывод, что дополнительная оболочка, сформированная размотанными полимерными волокнами и аминокислотами, захваченными между волокнами, препятствует доступу к поверхности мембраны не только аминокислотам, но и молекулам воды, т. е. замедляет набухание.
Исключение составляет суспензия глутаминовой кислоты: ее зависимость I(t) примерно одинакова для раствора NaCl на основе обычной воды и на основе DDW, см. Рисунок 6f. По-видимому, глутаминовая кислота способна проникать сквозь размотанные полимерные волокна, т.е. для этой аминокислоты эффект тушения люминесценции одинаков как в суспензии на основе обычной воды, так и в суспензии на основе DDW. Это следует рассматривать как специфическую особенность этой аминокислоты.
Как показано в [11], центрами люминесценции являются сульфонатные группы, которые, согласно [1], отрицательны и испытывают кулоновское притяжение к положительно заряженным аминокислотам (это лизин, а также, по-видимому, гистидин и аланин, см. [31] и данные pI в таблице 1). Кроме того, существует притягивающее кулоновское взаимодействие между отрицательными сульфонатными группами и нейтральными аминокислотами (глутаминовой и аспарагиновой кислотами, которые близки к изоэлектрической точке при pH = 3, см. [31] и Таблицу 1). Для описания взаимодействия между аминокислотами и поверхностью мембраны необходимо задействовать теоретические модели, основанные на дисперсионных взаимодействиях между заряженными частицами и поверхностями, включая биологические мембраны, см. [35]. В настоящее время мы разрабатываем соответствующие теоретические подходы для описания взаимодействия аминокислот с заряженной поверхностью нафиона с учетом эффекта раскручивания.
Как известно (см., например, [33], а также [36–39]), тушение люминесценции контролируется процессами переноса заряда между центром люминесценции и гасителем (в нашем случае аминокислотой). Поскольку мы имеем дело с взаимодействием положительной/нейтральной аминокислоты с отрицательной сульфонатной группой, природа тушения люминесценции в нашем случае также связана с переносом заряда. Напомним, что реализован логический двоичный элемент, основанный на эффекте тушения люминесценции с участием аспарагиновой кислоты, см. [21]. Как указано в разделе «Введение», одной из целей нашей работы было изучение возможности эффектов тушения люминесценции для создания двоичного элемента в системе «мембрана нафиона-аминокислотная суспензия» с учетом разматывающего эффекта полимерных волокон/в отсутствие этого эффекта.
В этом эксперименте пластину нафиона сначала пропитывали суспензией глутаминовой кислоты (1 г/л), приготовленной в солевом растворе на основе обычной воды объемом V; в этом случае сигнал люминесценции довольно быстро достиг нулевого уровня, см. рис. 6е. После 80 мин вымачивания нафиона добавляли такой же объем V суспензии лизина (1 г/л, также приготовленный в солевом растворе на основе обычной воды).Зависимости I(t) от времени замачивания представлены на рисунке 7.
Мы можем видеть, что добавление суспензии лизина приводит к резкому увеличению I(t) с последующим медленным спадом. Причина резкого увеличения I(t), на наш взгляд, заключается в следующем: поскольку при pH = 3 лизин положительный, а глутаминовая кислота нейтральна (см. Таблицу 1), они испытывают притягивающее взаимодействие, т. е. образуют Кулоновский комплекс на поверхности мембраны.
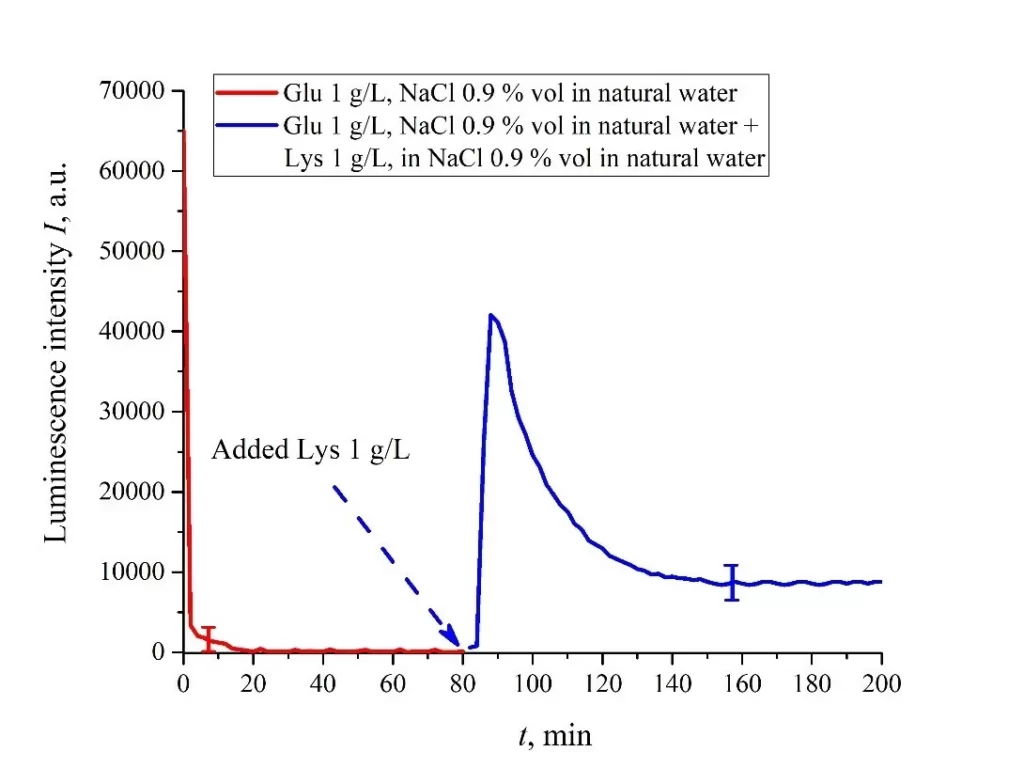
Рисунок 7. Зависимость I(t) от времени пропитывания в солевом растворе (0,9 об.% NaCl) на основе обычной воды при добавлении суспензии лизина (1 г/л), приготовленной в солевом растворе на основе обычной воды. Добавление суспензии лизина происходило на 80-й минуте. Объемы V суспензий глутаминовой кислоты и лизина одинаковы.
В этом случае можно говорить об изменении процессов переноса заряда от центра люминесценции (сульфонатная группа) к тушителю люминесценции (глутаминовая кислота), что может привести к прекращению тушения. Напомним, что целью этого эксперимента было изучение возможности создания двоичного элемента на основе этой системы.
Очевидно, что для суспензий аминокислот, приготовленных в физиологическом растворе на основе обычной воды, реализация логического элемента невозможна из-за динамического поведения интенсивности люминесценции I(t) после восстановления лизином.Случай суспензий на основе DDW представлен на рис. 8а, б. Панель (а) соответствует добавлению суспензии лизина с концентрацией 0,1 г/л (50-я минута), а панель (b) относится к добавлению суспензии лизина с концентрацией 1 г/л (80-я минута). Объем V суспензии лизина был равен исходному объему V суспензии глутаминовой кислоты для обоих случаев. Мы видим, что добавление лизина приводит к резкому увеличению и достижению квазистационарного уровня I(t). Как следует из графиков, этот уровень контролируется концентрацией лизина: для концентрации лизина 1 г/л скачок намного выше. Зависимости для DDW условно можно рассматривать как эффект переключения (триггера) при тушении люминесценции.
Важно, что в случае DDW уровень люминесценции после восстановления (добавления суспензии лизина) примерно такой же, как в случае с обычной водой, см. Рисунок 7. Обратите внимание, что триггерные эффекты используются для создания логических элементов для компьютеров. Таким образом, суспензии аминокислот на основе DDW могут быть перспективной средой для разработки компьютеров на основе биологических процессов.
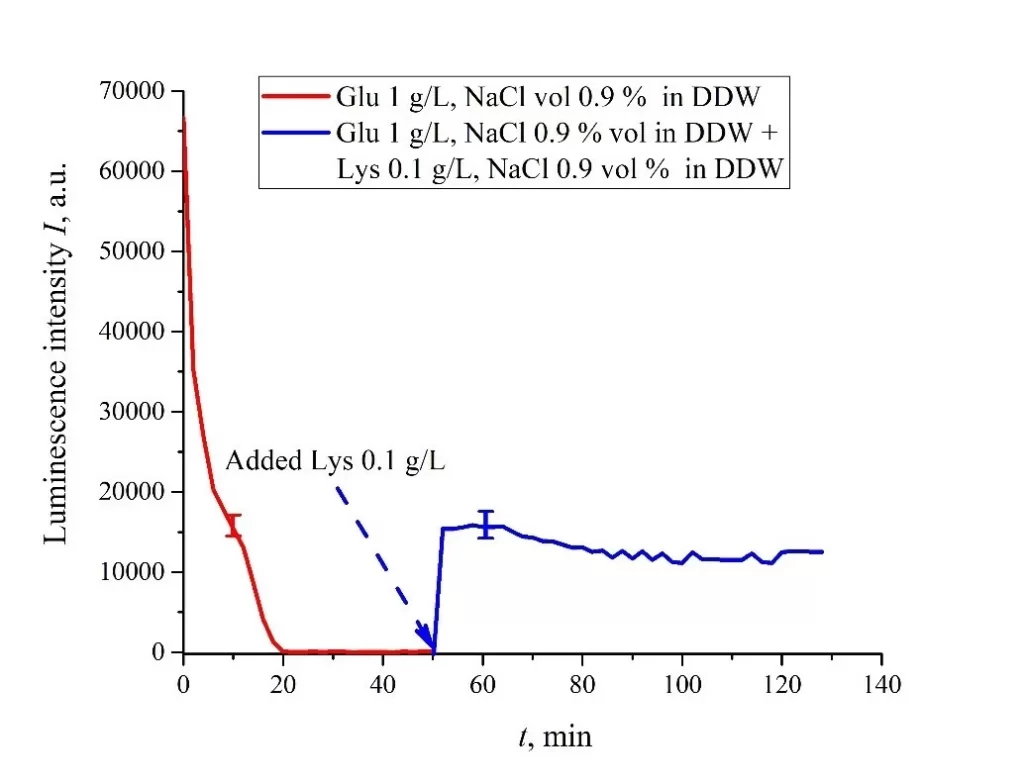
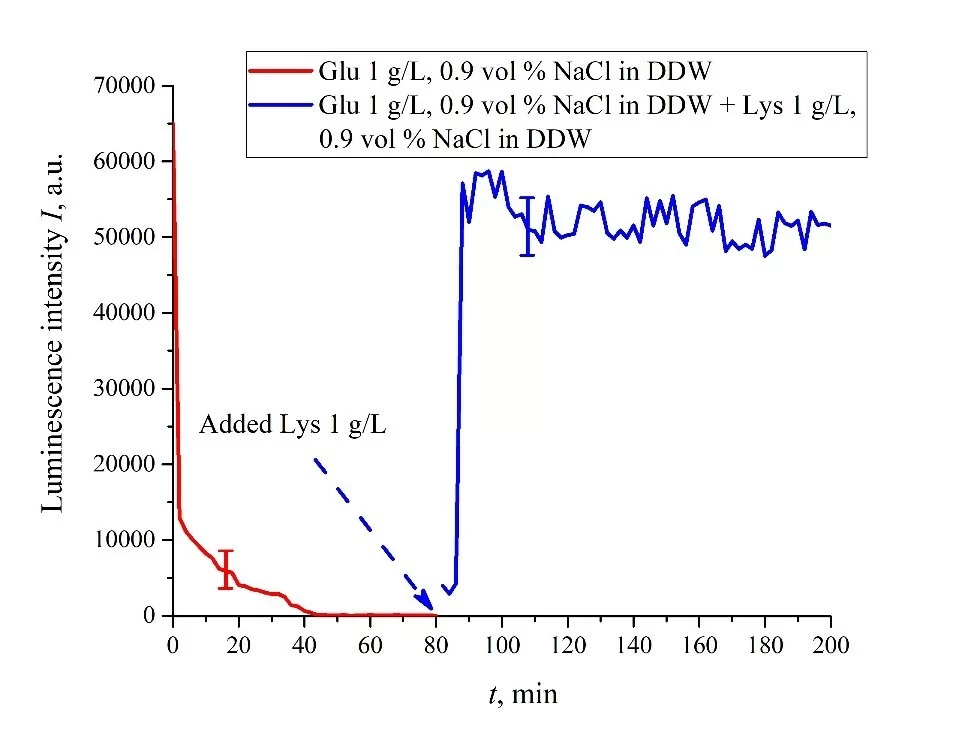
Рисунок 8. Интенсивность люминесценции I(t) в зависимости от времени пропитывания в физиологическом растворе на основе DDW (0,9 об.% NaCl), содержащем суспензию глутаминовой кислоты (1 г/л). Суспензию лизина (1 г/л, также физиологический раствор на основе DDW) добавляли на 50/80-й минуте; объемы V суспензий глутаминовой кислоты и лизина равны. Панель (а) соответствует добавлению суспензии лизина с концентрацией 0,1 г/л на 50-й минуте. Панель (b) соответствует добавлению суспензии лизина с концентрацией 1 г/л на 80-й минуте.
Если мы еще раз добавим объем V суспензии глутаминовой кислоты (1 г/л), приготовленной в растворе NaCl на основе DDW, к смеси суспензий глутаминовой кислоты и лизина (см. Рис. 8b), это снова вызовет резкое уменьшение сигнала люминесценции I(t), см. рис. 9.
Таким образом, альтернативное добавление и удаление суспензии лизин/глутаминовая кислота, приготовленной в физиологических растворах на основе DDW, может быть перспективным для создания логического двоичного элемента 0 – 1 – 0 на основе биологических частиц. Отметим в этой связи, что создание электронных устройств на основе биологических объектов — динамично развивающаяся тема в современной биологии, см. монографию [40].
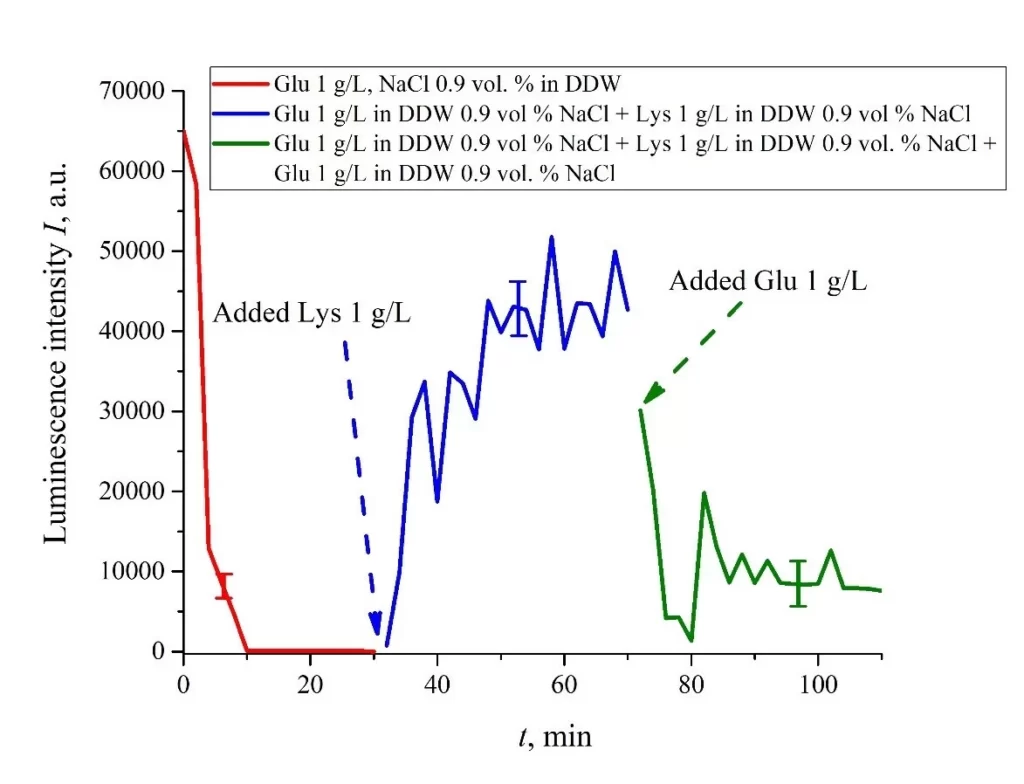
Рисунок 9. Интенсивность люминесценции I(t) в зависимости от времени пропитывания в физиологических растворах на основе DDW (0,9 об.% NaCl), содержащих суспензию глутаминовой кислоты (концентрация 1 г/л). На 30-й минуте добавляли суспензию лизина (1 г/л), приготовленную в физиологическом растворе на основе DDW; объемы V суспензий глутаминовой кислоты и лизина одинаковы. Затем на 70-й минуте снова добавляли суспензию глутаминовой кислоты того же объема V и концентрации 1 г/л.
Мы можем представить, что суспензии аминокислот, вызывающие эффекты тушения/восстановления люминесценции от мембраны нафиона, могут быть использованы для разработки логических элементов в биологических компьютерах.
5. ВЫВОДЫ
- Важно учитывать эффекты тушения люминесценции в экспериментах по спектроскопии фотолюминесценции, где изучается взаимодействие аминокислот с мембраной нафиона.
- Динамика набухания мембраны нафиона и тушения люминесценции аминокислотами различна для физиологических растворов, приготовленных на обычной воде (содержание дейтерия 157 чнм) и DDW (содержание дейтерия ≤ 1 чнм). Уровень интенсивности стационарной люминесценции I(t) для обычной воды намного выше, чем для DDW, что связано с защитной функцией полимерных волокон, размотанных в объем жидкости, и захваченных аминокислот.
- Добавление суспензии лизина приводит к резкому увеличению люминесценции нафиона после длительного вымачивания в суспензии глутаминовой кислоты. Величина скачка зависит от концентрации лизина и содержания дейтерия в суспензии.
- Эффекты гашения/восстановления люминесценции сульфонатных групп за счет добавления аминокислот с противоположными зарядами могут быть использованы для создания логического двоичного элемента на основе нафиона в аминокислотных суспензиях на основе DDW.
ЛИТЕРАТУРА
- Mauritz, K.A.; Moore, R.B. State of understanding of Nafion. Chem. Rev. 2004, 104, 4535–4585.
- Ghadiri, M.; Kang, A.K.; Nima, E.; Gorji, N.E. XRD characterization of graphene-contacted perovskite solar cells: moisture degradation and dark-resting recovery. Superlattices Microstruct. 2020, 146, 106677.
- Chai, B.; Yoo, H.; Pollack, G.H. Effect of Radiant Energy on Near-Surface Water. J. Phys. Chem. B 2009, 113, 13953–13958.
- Bass, M.; Berman, A.; Singh, A.; Konovalov, O.; Freger, V. Surface-induced micelle orientation in Nafion films. Macromolecules 2011, 44, 2893–2899.
- Gebel, G. Structural evolution of water swollen perfluorosulfonated ionomers from dry membrane to solution. Polymer 2000, 41, 5829–5838.
- Garzon, F.H.; Rockward, T.; Urdampilleta, I.G.; Brosha, E.L.; Uribe, F.A. The Impact of Hydrogen Fuel Contaminates on Long-Term PMFC Performance. ECS Trans. 2006, 3, 695–703.
- Pollack, G.H. The Fourth Phase of Water; Ebner and Sons Publishers: Seattle, WA, USA, 2013.
- Attard, P.; Mitchell, D.J.; Ninham, B.W. The attractive forces between polar lipid bilayers. Biophys. J. 1988, 53, 457–460.
- Elton, D.C.; Spencer, P.D.; Riches, J.D.; Williams, E.D. Exclusion zone phenomena in water—A critical review of experimental findings and theories. Int. J. Mol. Sci. 2020, 21, 5041.
- Bunkin, N.F.; Gorelik, V.S.; Kozlov, V.A.; Shkirin, A.V.; Suyazov, N.V. Colloidal Crystal Formation at the Nafion-Water Interface. J. Phys. Chem. B. 2014, 118, 3372–3377.
- Bunkin, N.F.; Shkirin, A.V.; Kozlov, V.A.; Ninham, B.W.; Uspenskaya, E.V.; Gudkov, S.V. Near-surface structure of Nafion in deuterated water. J. Chem. Phys. 2018, 149, 164901.
- Ninham, B.W.; Bolotskova, P.N.; Gudkov, S.V.; Juraev, Y.; Kiryanova, M.S.; Kozlov, V.A.; Safronenkov, R.S.; Shkirin, A.V.; Uspenskaya, E.V.; Bunkin. N.F. Formation of Water-Free Cavity in the Process of Nafion Swelling in a Cell of Limited Volume; Effect of Polymer Fibers Unwinding. Polymers 2020, 12, 2888.
- Goodsell, D.S. The Machinery of Life; Springer Science + Business Media: Berlin/Heidelberg, Germany, 2009.
- Craig, H. Standard reporting concentrations of deuteriumand oxygen-18 in natural water. Science 1961, 133, 1833–1834.
- Baker, D.R.; Simmerman, R.F.; Sumner, J.J.; Bruce, B.D.; Lundgren, C.A. Photoelectrochemistry of photosystem I bound in nafion. Langmuir 2014, 30, 13650–13655.
- Fromme, P.; Jordan, P.; Krauß, N. Structure of photosystem I. Biochimica et Biophysica Acta (BBA) Bioenerg. 2001, 1507, 5–31.
- Fu, C.; Yang, W.; Chen, X.; Evans, D.G. Direct electrochemistry of glucose oxidase on a graphite nanosheet—Nafion composite film modified electrode. Electrochem 2009, 11, 997–1000.
- Valdes, T.I.; Ciridon, W.; Ratner, B.D.; Bryers, J.D. Surface modification of a perfluorinated ionomer using a glow discharge deposition method to control protein adsorption. Biomaterials 2008, 29, 1356–1366.
- Valdes, T.I.; Ciridon, W.; Ratner, B.D.; Bryers, J.D. Modulation of fibroblast inflammatory response by surface modification of a perfluorinated ionomer. Biointerphases 2011, 6, 43.
- Cheng, Y.; Moraru, C.I. Long-range interactions keep bacterial cells from liquid-solid interfaces: Evidence of a bacteria exclusion zone near Nafion surfaces and possible implications for bacterial attachment. Colloids Surf. B Biointerfaces2018, 162, 16.
- Ji, G.; Zheng, T.; Gao, X.; Liu, Z. A highly selective turn on luminescent logic gates probe based on postsynthetic MOF for aspartic acid detection. Sens. Actuators B Chem. 2019, 284, 91–95.
- Bunkin, N.F.; Bolotskova, P.N.; Bondarchuk, E.V.; Gryaznov, V.G.; Gudkov, S.V.; Kozlov, V.A.; Okuneva, M.A.; Ovchinnikov, O.V.; Smoliy, O.P.; Turkanov, I.F. Long-Term Effect of Low-Frequency Electromagnetic Irradiation in Water and Isotonic Aqueous Solutions as Studied by Photoluminescence from Polymer Membrane. Polymers 2021, 13, 1443.
- Berne, B.J.; Pecora, R. Dynamic Light Scattering; Krieger: Malabar, FL, USA, 1990.
- Chu, B. Laser Light Scattering; Academic Press: New York, NY, USA, 1974.
- Bunkin, N.F.; Shkirin, A.V.; Suyazov, N.V.; Babenko, V.A.; Penkov, N.V.; Belosludtsev, K.N.; Gudkov, S.V. Formation and dynamics of ion-stabilized gas nanobubble phase in the bulk of aqueous electrolyte solutions. J. Phys. Chem. B 2016, 120, 1291–1303.
- Yurchenko, S.O.; Shkirin, A.V.; Ninham, B.W.; Sychev, A.A.; Babenko, V.A.; Penkov, N.V.; Kryuchkov, N.P.; Bunkin, N.F. Ion-specific and thermal effects in the stabilization of the gas nanobubble phase in bulk aqueous electrolyte solutions. Langmuir 2016, 32, 11245–11255.
- Millero, F.J.; Lo Surdo, A.; Shin, C. The apparent molal volumes and adiabatic compressibilities of aqueous amino acids at 25 °C. J. Phys. Chem. 1978, 82, 7, 784–792.
- Cohn, E.J.; Edsall, J.T. Proteins, Amino Acids and Peptides; Reinhold: New York, NY, USA, 1943; pp. 370–381.
- Jolicoeur, C.; Boileau, J. Apparent molal volumes and heat capacities of low molecular weight peptides in water at 25 °C. Can. J. Chem. 1978, 56, 2707–2713.
- Available online: http://marlin.bio.umass.edu/biology/kunkel/probe/ buffers/aa.html (accessed on 9 July 2021).
- Available online: https://chem.libretexts.org/Bookshelves/ Organic_Chemistry/ Map%3A_Organic_Chemistry(Wade)/ 25%3A_Amino_Acids_Peptides_and_Proteins/ 25.02%3A_Isoelectric_Points_and_Electrophoresis (accessed on 9 July 2021).
- Lakowicz, J.R. Principles of Fluorescence Spectroscopy; Springer: Boston, MA, USA, 2006; Chapter 16, Protein Fluorescence; pp. 529–575.
- IBID. Chapter 8, Quenching of Fluorescence; pp. 277–330.
- Davies, B.; Ninham, B.W.; Richmond, P. Van der Waals forces between thin cylinders: New features due to conduction processes. J. Chem. Phys. 1973, 58, 744–750.
- Israelachvili, J.N. Intermolecular and Surface Forces; Elsevier: Amsterdam, The Netherlands; Academic Press: Cambridge, MA, USA, 2011.
- Waka, Y.; Hamamoto, K.; Mataga, N. Heteroexcimer systems in aqueous micellar solutions. Photochem. Photobiol. 1980, 32, 27–35.
- Atherton, S.J.; Beaumont, P.C. Quenching of the fluorescence of DNA-intercalated ethidium bromide by some transition metal ions. J. Phys. Chem. 1986, 90, 2252–2259.
- Ando, T.; Asai, H. Charge effects on the dynamic quenching of fluorescence of fluorescence of 1,N6-ethenoadenosine oligophosphates by iodide, thallium (I) and acrylamide. J. Biochem. 1980, 88, 255–264.
- Ando, T.; Fujisaki, H.; Asai, H. Electric potential at regions near the two specific thiols of heavy meromyosin determined by the fluorescence quenching technique. J. Biochem. 1980, 88, 265–276.
- Facci, P. Biomolecular Electronics; Elsevier: Amsterdam, The Netherlands, 2014.


 Назад
Назад


