Аннотация. Обоснование. Изучение новых методов местной терапии при поражениях различной глубины является актуальной задачей современной ожоговой медицины. Цель исследования – оценка эффективности слабых неионизирующих нетепловых электромагнитных полей в процессах заживления ожоговых ран у кроликов. Материалы и методы исследования. Нерандомизированное экспериментальное исследование было проведено в учебном виварии Дальневосточного государственного аграрного университета (Россия) на 24 кроликах в возрасте 1,5 лет со средним весом 3,2 кг, разделенных на 2 равные группы. В первой группе лечение ЭМП не применялось, модельные ожоговые раны обрабатывались 0,9 % раствором NaCl, во второй группе раны подвергались такой же терапии в сочетании с дистанционной элетромагнитной терапией на расстоянии 12 м. Продолжительность исследования составила 30 дней. Результаты и их обсуждение. На протяжении всего эксперимента в опытной группе наблюдалась высокая скорость заживления раны. На 21-й день средняя площадь раны в экспериментальной группе уменьшилась на 18 см2 по мере интенсивного развития грануляционной ткани. В конце эксперимента, в экспериментальной группе, в отличие от контрольной, было отмечено отсутствие на раневой поверхности высокопатогенной кишечной и синегнойной палочки и различных культур протея. Лабораторные изменения у кроликов контрольной группы характеризовали явления сепсиса с полиорганной недостаточностью. В опытной группе все значимые биохимические показатели были в норме на протяжении всего эксперимента. К 8-10-му дню все животные из контрольной группы погибли, а в опытной группе остались живы. На секции умерших в контрольной группе выявлены признаки острого сепсиса, а в опытной – эндотоксикоза. Выводы. Применение электромагнитной терапии ускорило процессы заживления ожоговых ран у экспериментальных животных и оказало системный противовоспалительный эффект, обусловивший высокую выживаемость животных экспериментальной группы. Ключевые слова: неинвазивная электромагнитная терапия, слабые импульсные неионизированные нетепловые электромагнитные поля, ЭМП, ПЭМП, ожоговые раны, доклинические испытания, Гц.
Введение
Основными задачами комбустиологии в настоящее время являются не только поиск различных новых методов экстракорпоральной детоксикации, коррекция белковой недостаточности, восстановление коагуляционного и тромбогемостаза, но и поиск новых способов местного лечения ожогов различной глубины [3]. В этой связи особенно интересным представляется поиск новых инновационных методик при поверхностных (I-II) и пограничных (IIIA – IIIБ) ожоговых повреждениях (классификация XXVII Всесоюзного съезда хирурга) [1]. Доля этих видов ожогов в общей структуре заболеваемости составляет 60-80 % на 100 тыс. больных [7]. Если при I — II степени улучшение качества местного лечения лишь ускоряет заживление ожоговых поверхностей вне зависимости от их площади, то, в случае пограничных ожогов, очень часто может явиться решающим фактором дальнейшего хода процесса [13]. Дело в том, что при ожогах III AБ степени отмечается поражение кожи на уровне сетчатого слоя дермы, и источником эпителия, необходимым для регенерации являются уцелевшие придатки кожи: волосяные фолликулы и сальные железы [1]. В этой связи, неадекватно использованная местная терапия, а также присоединение бактериальной инфекции может способствовать вторичному углублению ожоговой раны и большему по тяжести и длительности заболеванию [8, 9]. При данном варианте ожога выделяют три гистологических зоны поражения. Первая – зона коагуляции, где отмечается тотальный некроз ткани [1]. Вторая – зона стаза (Jackson, 1953), в которой отмечаются микроциркуляторные нарушения и явления паранекроза за счёт повреждающего действия различных острофазовых биохимических сдвигов с выделением большого количества свободных радикалов кислорода и активизации перекисного окисления липидов [4, 12]. Именно за счёт этой зоны происходит феномен вторичного углубления ожоговой поверхности, поскольку, при отсутствии адекватного лечения, данная зона также подвергается тотальному некрозу. Кроме того, выделяют третью зону – зону гиперемии, где воспалительные изменения характеризуются покраснением и отеком [1]. Таким образом, поиск новых средств местного воздействия на зону стаза (паранекроза) с противовоспалительной целью, позволит кардинально улучшить результаты лечения у данной группы пациентов. В совокупности с появлением различных новых композиционных материалов, использующихся в качестве раневых покрытий, в литературе появляются интересные данные о влияния воздействия электромагнитного излучения (ЭМИ) различной величины на ожоговую поверхность [14-17]. Изучение зависимости эффектов ЭМИ на ожоговые раны от частоты и интенсивности в настоящее время не проводилось. Механизмом возникновения ЭМИ, обеспечивающим реализацию вышеописанных эффектов, является чувствительная к ЭМИ способность к кластеризации сферических нанопузырьков в межклеточной жидкости – бабстонов. Эти заряженные пузырчатые образования могут влиять на ионный обмен через каналы клеточной мембраны [17]. Таким образом, изучение воздействия ЭМИ на ожоговые раны является передовым моментом современной комбустиологии. Пандемия COVID-19 потребовала обращения к технологиям электромагнитного излучения, которые ранее эффективно применялись в мировой системе здравоохранения. Тщательный анализ многочисленных результатов, полученных в этой области, привел исследователей к разработке технологий дистанционного подавления патогенов с низким уровнем шума. Устройство для неинвазивной электромагнитной терапии «ТОР», разработанное с использованием технологии subnoise, успешно прошло рандомизированные контролируемые клинические испытания при лечении пациентов с легкой и среднетяжелой формой заболевания Sars-Cov-2 в COVID-клинике Самарского государственного медицинского университета [18].
Цель исследования – оценка эффективности слабых неионизирующих нетепловых электромагнитных полей в процессах заживления ожоговых ран у кроликов. Материалы и методы исследования. Проспективное нерандомизированное исследования проводили в условиях учебного вивария факультета ветеринарной медицины, зоотехнии и биотехнологий ФГБОУ ВО Дальневосточного ГАУ в период с июня 2024 года по настоящее время на 24 беспородных кроликах, возрастом 1,5 года, средней массой 3,2 кг. Для лечения ожоговых инфицированных ран использовали устройство электромагнитной терапии «ТОР», использованное в COVID-клинике Самарского государственного медицинского университета. Аппарат неинвазивной электромагнитной терапии «TOР» зарегистрирован в качестве медицинского изделия в Государственном реестре Федеральной службы по надзору в сфере здравоохранения Российской Федерации (№RZN 2021/15459 от 23 сентября 2021 года, регистрационное досье № RD36804/79643). Принцип действия Аппарата «ТОР» основан на слабом неионизирующем нетепловом электромагнитном излучении, непрерывно генерируемом высоковольтными импульсами вольфрамовых электродов. Частота импульсов находится в диапазоне 100-150 Гц, каждый меандроподобный волновой пакет имеет частотный режим 25 кГц. Потребляемая мощность при работе составляет 12Вт максимальная — 150 Вт. Напряжение на вольфрамовых электродах не превышает 8 кВ. Электромагнитное излучение «ТОР» соответствует Национальным требованиям здравоохранения Р оссийской Федерации [18]. После проведения моделирования ожоговых ран кожного покрова размером 5,0 см, которое осуществляли путем прижигания раскаленным металлическим клеймом, диаметром 5,5 см в межлопаточной области в течении 10с, без давления, животных разделили на 2 группы. В первой (опытной) группе было 12 кроликов, которые лечение не получали, а обработка ран проводилась только 0,9 % раствором NaCl, без использования дополнительных медикаментозных средств. Во второй группе также было 12 кроликов, обработка ран проводилась 0,9 % раствором NaCl с совместным воздействием аппаратом «ТОР» сразу же после моделирования раны, на 3-й, 5-й, 8-й,12-й,17-й, 21-й, 26-й день эксперимента. Длительность исследования составила 30 дней.
Площадь ожоговых ран рассчитана способом V. Schubert [2] по формуле: , где L – длина раны, W – ширина раны. Таким образом, фоновая площадь ожоговой поверхности в двух группах у животных в среднем составила 19,07 ± 1,25 см. Некрэктомию животным как опытной, так и контрольной группы не выполняли. Ежедневно проводился клинический контроль состояния животных, оценка местного статуса и термометрии. Кроме этого, выполнялся клинический и биохимический анализ крови. В последнем оценивались: общий белок, альбумин, глюкоза, креатинин, мочевина, АЛТ, АСТ, билирубин общий, билирубин прямой, щелочная фосфотаза, калий, натрий, хлор, холестерин, триглицериды, гаммаглутамилтрансфераза (ГГТ), альфа-амилаза, лактатдегидрогеназа (ЛДГ), гамма-ГТ (гамма-глутамилтрансфераза), кальций общий, мочевая кислота). Кроме того, выполнялось микробиологическое исследование раневого содержимого. Частота выполнения описанных исследований: всем животным перед моделированием ран, у кроликов контрольной группы — на 5-й и на 8-й день, у кроликов опытной группы — на 5-й, 8-й, 12-й, 17-й и 21-й день. Проводился забор красного костного мозга перед экспериментом, а также на 8-й и 21-й дни его проведения. Падших животных, а также выводимых из эксперимента кроликов путем забоя — подвергали патологоанатомическому исследованию. Все лабораторные исследования проводили в аккредитованной ветеринарной лаборатории «ВЕТ ЮНИОН» на сертифицированном оборудовании по договору о выполнении лабораторных исследований в ветеринарии № 4089 от 10.06.2024 г. При проведении научных исследований придерживались требований биоэтики согласно Национальным «Общим этическим принципам экспериментов на животных», соответствующим положения «Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей» от 18 марта 1986г. Проведение исследования одобрено локальным этическим комитетом Дальневосточного государственного аграрного университета Российской Федерации (протокол № 7 от 14.04.2024) Статистическая обработка материала. При анализе цифровых результатов определяли биометрические величины: М – средняя арифметическая вариационного ряда, X – обозначение числа (величины), n – число наблюдений (число вариант), а – амплитуда вариационного ряда, m – среднеквадратичная ошибка (средняя ошибка, стандартная ошибка) сред-ней арифметической величины вариационного ряда, J – коэффициент для вычисления среднеквадратичной ошибки (J = 0,02), R — коэффициент для вычисления доверительных интервалов (R = 0,05), q — процент суммы, Σ – сумма вариант, L – величина доверительного интервала средней арифметической величины вариационного ряда. Математическую обработку данных осуществляли с помощью программы Microsoft Excel 2010. Для определения доверительного интервала использовали таблицу Р. Б. Стрелкова.
Результаты и их обсуждение. В контрольной группе на 5 сутки после моделирования ожоговой раны, площадь раны увеличилась в среднем на 11,27 см2 , а с 5 по 8 сутки на 3,9 см2 .
При анализе опытной группы у 3 голов животных выявлено интенсивное заживление ожоговых ран начиная с 5 суток исследования. На 8-е сутки эксперимента после трехкратного применения неинвазивного электромагнитного воздействия у всех опытных животных отмечено снижение площади ожоговой раны на 17,30 ± 5,06 см2 . Также у некоторых кроликов выявлены первые признаки начальной стадии развития грануляции ткани. Далее отмечается прогрессивное нарастание обозначенных тенденций. На 21 сутки после шестого раза применения электромагнитной терапии у всех опытных животных средняя площадь ран составила 1 см2 , при этом они уменьшились на 18 см2 с интенсивным развитием грануляционной ткани. У шести голов из данной группы к данному периоду наблюдалось полное заживление ожоговой раны с формированием начального волосяного покрова на поверхности зажившей ткани. Тенденция по скорости заживления ран продемонстрирована в табл. 1. Визуализация ран в различные фазы эксперимента представлена на рис. 1.
Таблица 1
Площадь ожоговых инфицированных ран на теле кроликов в период эксперимента
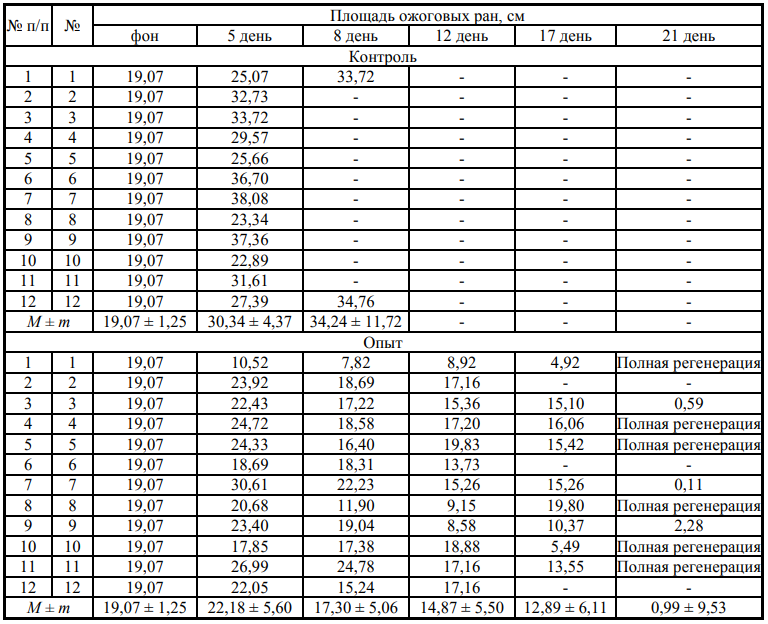
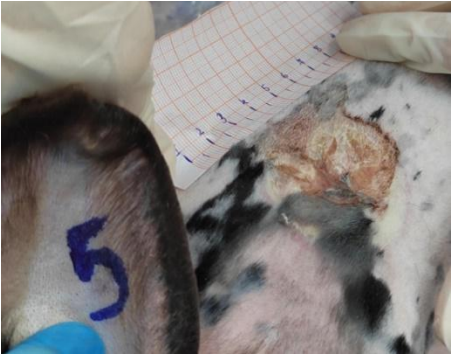
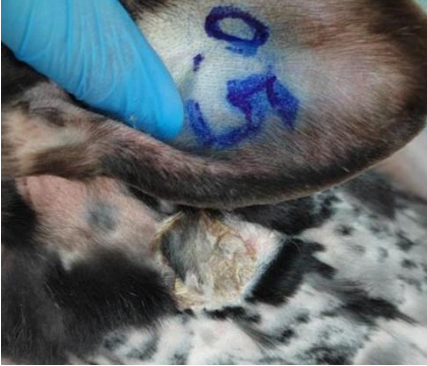
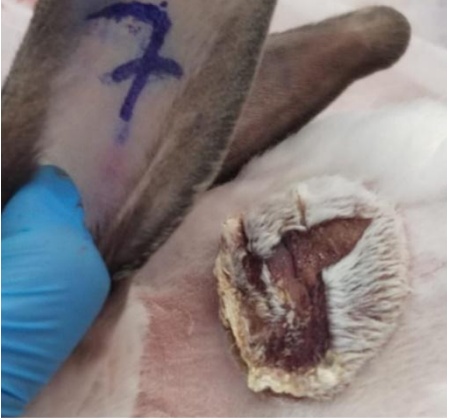
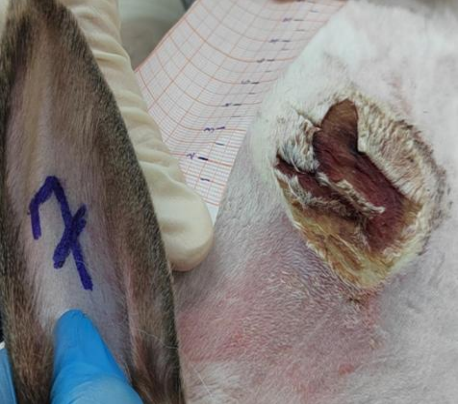
Рис. 1. Динамика заживления ожоговых ран с 5 по 21 сутки в группах исследования (А – опыт 5 сутки, Б – опыт 21 сутки, В – контроль 2 сутки, Г – контроль 8 сутки)
При оценке микробиоценоза кожи животного обоих групп перед моделировнием ожоговой раны в большинстве случаев выявлена условнопатогенная монокультура Staphylococcus epidermidis (× 106 КОЕ/мл). По результатам оценки на 5 сутки после моделирования ран микробного пейзажа у кроликов контрольной группы раневая микрофлора девяти кроликов соответствовала патогенным монокультурам и ассоциациям Enterobacter cloacae, Escherichia coli, Enterococcus faecalis, Proteus mirabilis, в концентрациях, превышающих ×105 КОЕ/тамп. В раневом отделяемом на 7 сутки эксперимента выявили рост Staphylococcus aureus и Pseudomonas aeruginosа в виде монокультур и микробных ассоциаций. При изучении микробного загрязнения ожоговой раны кроликов опытной группы на 5 сутки, после обработок аппаратом «ТОР», выявлен рост микрофлоры в виде монокультур (Staphylococcus equorum, Pantoea agglomerans, Staphylococcus sciuri, Staphylococcus aureus, Staphylococcus xylosus, Staphylococcus vitulinus) и микробных ассоциаций: (Enterobacter cloacae, Staphylococcus aureus). К седьмым суткам микробный состав ран опытной группы был представлен монокультурами стафилококка – Staphylococcus sciuri, Staphylococcus aureus, Staphylococcus xylosus. В дальнейшем к 21-30 суткам эксперимента микробиоценоз кожи кроликов опытной группы менялся многократно, однако необходимо отметить отсутствие на поверхности смоделированных ран высокопатогенной кишечной палочки, палочки «синего гноя» и различных культур протея. Анализируя данные клинического анализа крови, мы видим, что наблюдается стойкая эритроцитопения и снижение общего гематокрита, лейкоцитопения на протяжении всего времени проведения эксперимента (табл. 2).
Таблица 2
Показатели клинического анализа крови в динамике за весь период эксперимента
При изучении пунктатов костного мозга в группах исследования эритроидный, гранулоцитарный и мегакариоцитарный ростки значимых отклонений не имеют. Анализируя биохимические сдвиги в анализе крови у кроликов контрольной группы на 5-й и 8-й дни проведения опыта основные изменения касаются повышения активности печеночных трансаминаз в рамках цитолитического синдрома. Ниже референсных значений на 15 % по сравнению с нормой оказался уровень триглицеридов. Увеличение в 2 раза содержания холестерина (гиперхолестеринемия) у кроликов контрольной группы наблюдалось на 8- й день эксперимента. В этот же период отмечено появление амилаземии. Увеличение данного показателя составило больше 23 % по сравнению с нормой) (табл. 3).
Таблица 3
Показатели биохимического анализа крови кроликов в динамике за весь период эксперимента
В опытной группе на протяжении всего срока проведения эксперимента все значимые биохимические показатели находились в пределах референсных значений или их отклонения не имели значимого диагностического результата. Общие итоги эксперимента явились впечатляющими (табл. 4).
Таблица 4
Динамика падежа и дней планового убоя кроликов в период эксперимента
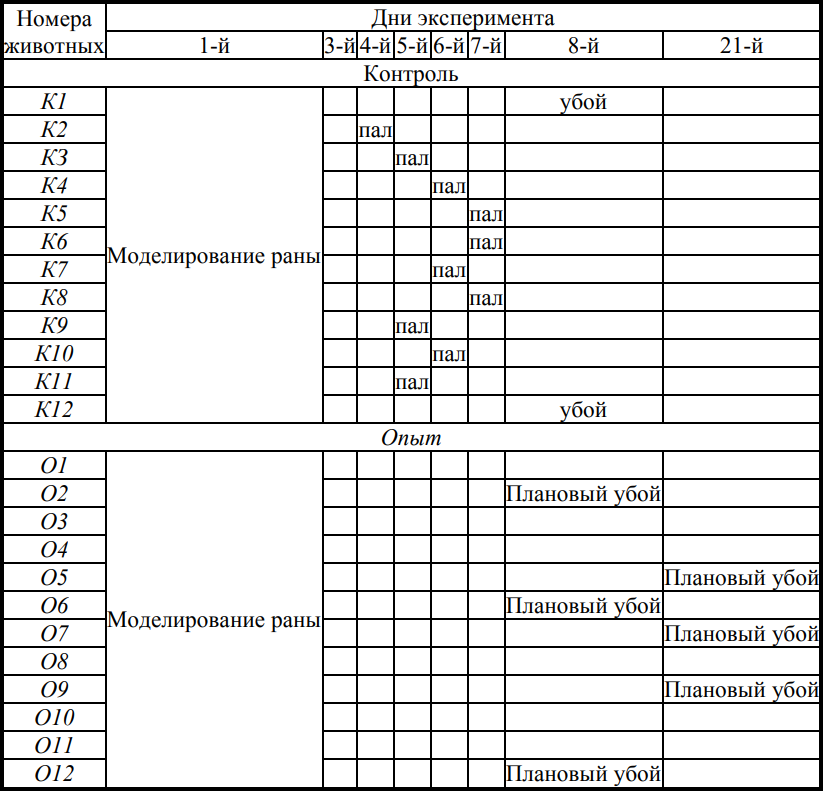
К 8 суткам отмечен падеж 10 животных из контрольной группы. В опытной группе, на фоне электромагнтной терапии, все животные остались живы. При патологоанатомическом исследовании умерших выявляется картина острого сепсиса: венозный застой всех паренхиматозных органов с резко выраженной инъекцией сосудов и множественными кровоизлияниями на серозных покровах, токсический гепатит, холангит с дискинезией желчевыводящих путей, нефрит с множественными кровоизлияниями, септический спленит с инфарктами. При секции выведенных из эксперимента животных определяются полиорганные проявления ожоговой болезни, токсицемии с поражение в основном печени и поджелудочной железы. У опытной группы патоморфологичские признаки эндотоксикоза были выражены в меньшей степени. В результате нашего эксперимента изучено влияние электромагнитного излучения на течение ожоговых ран поверхностной и пограничной глубины. Размышляя над причинами ускорения заживления ран при воздействии электромагнитного излучения, можно выделить две точки его местного приложения. С одной стороны, воздействуя на ионообменные каналы клеточной мембраны, ЭМИ повышает регенерационный потенциал сохранившегося эпителия кожных придатков в зонах ожогового паранекоза, усиливая его пролиферацию, улучшая микроциркуляцию близлежащих слоёв дермы [4-5]. Всё это способствует образованию новой грануляционной ткани, равномерно с проходящей эпителизацией. Тем самым, блокируется вторичнное углубление ожоговых ран, усиливаются процессы их констрикции. С другой стороны, снижается активность острофазовых реакций воспаления: подавляется перекисное окисление липидов, снижается образование активных радикалов кислорода, активируются антиоксидантные клеточные системы [5, 14-17]. Тем самым, процессы островоспалительной деструкции на клеточнотканевом уровне становятся более сбалансированными, что способствует процессам регенерации. Необходимо также отметить, что все комплексные процессы клеточно-теневого строительства проходит в определённом бактериальном микроокружении, непосредственно влияющем на них [12]. Наш эксперимент показал, что электромагнитное излучение уничтожает высоко патогенную микрофлору на раневой поверхности, препятствуя формированию бактериальных ансамблей даже условно патогенных организмов. Данные процессы способствуют ускорению заживления ран. Наряду с местными эффектами электромагнитного излучения,
важно подчеркнуть его органопротекторную функцию. Она имеет непосредственный механизм, заключающийся в стабилизации мембран клеток на фоне ожоговый эндотоксемии, что проявилось в нашем эксперименте сохранением биохимических констант крови в опытной группе, несмотря на имеющиеся ожоговую болезнь [5]. Данный факт нашел свое отражение на секции животных опытной группы в виде минимальных полиорганных изменений. Опосредованная органопротекция ЭМИ заключалось в снижении токсической нагрузки ввиду отсутствия углубления ожоговые раны, ее дополнительной контаминации, а так же усиления процессов её очищения и регенерации. Совокупность данных факторов способствовало выживанию животных опытной группы в условиях ожоговой болезни.
Выводы:
1. Неинвазивная электромагнитная терапия при лечении ожоговых ран (I-IIIA ст.) у модельных животных (кроликов) ускорила процессы их заживления.
2. Слабые неионизированные нетепловые импульсные электромагнитные поля могут рассматриваться как вспомогательное средство регенерации ожоговых ран (I-IIIA ст.) и применяться в сочетании с классическими методами их лечения.
3. Доклинические испытания на кроликах показали, что электромагнитная терапия, помимо местного воздействия, оказала системный иммуностимулирующий эффект, обеспечив выживание животных опытной группы в условиях ожоговой болезни, однако механизм такого воздействия все еще требует дальнейших исследований.
Литература
1.Емельянова А.М., Стяжкина С.Н., Федоров В.Г., Субботин А.В. Современные методы лечения гнойных и ожоговых ран // Вестник медицинского института «Реавиз». 2020. № 1. С. 27–34
2. Савченко Ю.П., Федосов С.Р. Методы определения размеров раневой поверхности. // Вестник хирургии имени И. И. Грекова. 2007. № 166 (1). с. 102-105.
3. Abousy M., Sylvester S., Milek D., Hultman C.S., Caffrey J. Surgical management and outcomes of levamisole-induced vasculitis in a burn center: A case series. // JAAD Case Rep. 2021. №13. С. 36-42. doi: 10.1016/j.jdcr.2021.04.028.
4. Adams B.. Petruccione F. Nature’s Novel Materials: A Review of Quantum Biology. In Encyclopedia of Condensed Matter Physics, 2nd ed., Chakraborty, T., Ed., Academic Press: Oxford, UK, 2024. pp. 593– 604. 5. Amini A., Pouriran R., Abdollahifar M.A., Abbaszadeh H.A., Ghoreishi S.K., Chien S., Bayat M. Stereological and molecular studies on the combined effects of photobiomodulation and human bone marrow mesenchymal stem cell conditioned medium on wound healing in diabetic rats. // J Photochem Photobiol B. 2018. № 182. р. 42-51.
6. Bunkin N.F. Bolotskova P.N., Bondarchuk E.V., Gryaznov V.G., Kozlov V.A., Okuneva M.A. Ovchinnikov O.V., Penkov N.V., Smoliy O.P., Turkanov I.F. Dynamics of Polymer Membrane Swelling in Aqueous Suspension of Amino-acids with Different Isotopic Composition // Photoluminescence Spectroscopy Experiments. Polymers. 2021. № 13. р. 2635.
7. Britton G.W., Wiggins A.R., Halgas B.J., Cancio L.C., Chung K.K. Critical Care of the Burn Patient. // Surg Clin North Am. 2023. №103(3). С. 415-426. doi: 10.1016/j.suc.2023.01.005.
8. Chai J.K., Zheng Q.Y., Li L.G. Analysis on treatment of eight extremely severe burn patients in August 2nd Kunshan factory aluminum dust explosion accident. // Zhonghua Shao Shang Za Zhi. 2018. № 34(6). 332-338. doi: 10.3760/cma.j.issn.1009-2587.2018.06.004.
9. Chen B., Zhao J., Zhang Z., Li G., Jiang H., Huang Y., Li X. Clinical characteristics and risk factors for severe burns complicated by early acute kidney injury. // Burns. 2020. №46(5). р. 1100-1106. doi: 10.1016/j.burns.2019.11.018. 10. Dastgheib M., Shaddel M., Saba V., Homayouni M.M., Fereydoni A. Role of magnetic Field in the Healing of Cutaneous Leishmaniasis Lesions in Mice. // Arch Razi Inst. 2020. № 75(2)., pp. 227-232.
11. Fatenkov O.V., Davydkin I.L., Yashkov A.V., Gubareva E.Yu., Komarova M.V., Bondarchuk E.V., Ovchinnikov O.V., Turkanov I.F., Gryaznov V.G., Vaganov A.G., Smoliy O.P., Galkina C.A., Partala A.V. Dolgikh O.V. Bunkin N.F. Kozlov V.A. Bolotskova P.N. Dmitriev A.S. Alexandr A. Semenov A.A. Efficacy of the TOR Non-invasive lectromagnetic Therapy Device for Remote Treatment of COVID-19: Phase II Clinical Trial. Results. Bull. // Med. Inst. Cont. Edu. 2024. № 4 (4). pp.25–34.
12. Guo J, Wei W, Zhao Y, Dai H. Iron oxide nanoparticles with photothermal performance and enhanced nanozyme activity for bacteria-infected wound therapy. // Regen Biomater. 2022. № 23. Р.9.
13. Klifto K.M., Gurno C.F., Seal S.M., Hultman C.S. Factors Associated With Mortality Following Burns Complicated by Necrotizing Skin and Soft Tissue Infections: A Systematic Review and Meta-Analysis of Individual Participant Data. // J Burn Care Res. 2022. №43(1). pp. 163-188. doi: 10.1093/jbcr/irab045.
14. Kouhkheil R, Fridoni M, Piryaei A, Taheri S, Chirani A.S., Anarkooli I.J., Nejatbakhsh R, Shafikhani S, Schuger L.A., Reddy V.B., Ghoreishi S.K., Jalalifirouzkouhi R, Chien S, Bayat M. The effect of combined pulsed wave low-level laser therapy and mesenchymal stem cell-conditioned medium on the healing of an infected wound with methicillin-resistant Staphylococcal aureus in diabetic rats. // J Cell Biochem. 2018. № 119(7). рр. 5788-5797.
15. Wang X., Shi Q., Zha Z., Zhu D., Zheng L., Shi L., Wei X., Lian L., Wu K., Cheng L. Copper single-atom catalysts with photothermal performance and enhanced nanozyme activity for bacteria-infected wound therapy. // Bioact Mater. 2021. №6(12). pp.4389-4401.
16. Wang L. Multifunctional Magnetic Copper Ferrite Nanoparticles as Fenton-like Reaction and Near-Infrared Photothermal Agents for Synergetic Antibacterial Therapy. // ACS Appl Mater Interfaces. 2019. №11(35). pp.31649-31660;
17. Yuan J., Xin F., Jiang W. Underlying Signaling Pathways and Therapeutic Applications of Pulsed Electromagnetic Fields in Bone Repair. // Cell Physiol Biochem. 2018. №46(4). pp.1581-1594.


 Назад
Назад


