Введение. Разработка новых способов лечения гнойных ран различной этиологии в хирургической практике является актуальной задачей.
Цель. Изучить влияние неинвазивной электромагнитной терапии на процесс заживления гнойных ран у кроликов. Материалы и методы. Эксперимент проведен на базе ФГБОУ ВО «Дальневосточный государственный аграрный университет» на 14 беспородных кроликах. После проведения моделирования гнойных ран кожного покрова на 5-е сут. кроликов разделили на 2 равные группы. Контрольной группе животных после проводилась лишь местная обработка ран физиологическим раствором, в опытной группе данная манипуляция сочеталась с элекромагнитной терапией. Длительность эксперимента составила 17 дней, наблюдения – 30 дней. Проводился клинический мониторинг состояния животных, контроль клинического анализа крови, выполнялись посевы раневого отделяемого. Оценка заживления ран проводилась планиметрическим методом. При статистическом анализе результатов определяли биометрические величины, использовали таблицу Р.Б. Стрелкова.
Результаты и обсуждение. К 9-му дню эксперимента у животных в опытной группе отмечена нормотермия, у 14,3% кроликов в контрольной группе сохранялась гипертермия. На 7-й день у 57,14% животных в контрольной группе рана уменьшилась на 1,0 см, а в опытной группе уменьшение от 0,5 до 1,0 см выявлено у 71,42%. На 14-й день в опытной группе, в отличие от контроля, микрофлора в ране не выявлена. На 5-й день лейкоцитоз превысил норму в контрольной группе на 3,0%, в опытной группе – на 67,7%. В опытной группе на всем протяжении эксперимента отмечался тромбоцитоз, который превышал к его концу первоначальные величины на 70,78%.
Выводы. Использование неинвазивной электромагнитной терапии в лечении гнойных ран у кроликов ускоряет процессы заживления. Ключевые слова: неинвазивная электромагнитная терапия, слабые импульсные неионизированные нетепловые электромагнитные поля, ЭМП, ПЭМП, инфицированные раны, доклинические испытания, Гц.
Ведение
Разработка новых способов лечения гнойных ран различной этиологии в современной хирургической практике является актуальной задачей. Причиной 40% всех осложнений в общей хирургии являются нагноения, а доля летальности от гнойной патологии после операции достигает 42% [1]. Развитие сосудистой хирургии облитерирующих заболеваний нижних конечностей без адекватного лечения гнойных трофических ран не имеет перспективы [1, 2]. В настоящее время инцизионно-дренажный метод является общепризнанным в лечении гнойных ран [3, 4]. Однако данный способ не лишен своих недостатков, основным из которых является длительное использование тампонов и дренажей, которые зачастую повреждают нежную грануляционную ткань и являются причиной вторичного инфицирования [3].
Степень нагноения ран определяется, с одной стороны, степенью контагиозности микроорганизма, его чувствительностью к антимикробным препаратам, а с другой – состоянием общей реактивности организма [1, 2]. В настоящее время интересным представляется воздействие низкочастотного электромагнитного излучения (ЭМИ) на течение гнойных ран. Исследования различных авторов показало неоднозначность эффектов ЭМИ в зависимости от частоты и времени воздействия [5]. В отечественной литературе общепризнанным является классификация течения раневого процесса, разработанная в НИИ им. А.В. Вишневского [6, 7].
Первой стадией в данной классификации является фаза воспаления, заключающаяся в паретическом расширении сосудов микроциркуляторного русла с последующей экссудацией и выпадением фибрина, а также выходом в ткань нейтрофильных лейкоцитов [6].
Важным событием в данной фазе течения раневого процесса является «респираторный взрыв» в нейтрофилах, сопровождающийся выходом большого количества активных форм кислорода, которые имеют высокую цитотоксичную активность как в отношении собственных разрушенных клеток, так и в отношении бактериальных агентов [8, с. 593–604; 9]
Необходимо отметить, что свободные радикалы кислорода вызывают ускорение процессов перекисного окисления липидов, субстратом которого являются фосфолипиды клеток и бактерии [10, 11]. Известно, что электромагнитное воздействие на определенных частотах в данную фазу способствует усилению оксидативного стресса, а также активности тканевых макрофагов, и, как следствие, ускорению течения первой фазы воспаления [12]. Вторая фаза раневого воспаления – регенерация, характеризуется снижением процессов экссудации, активацией фибринолиза с очищением раневой поверхности и формированием грануляций [6]. По своей сути данная стадия не отделена от третьей фазы – образования и регенерации рубца с эпителизацией. Электромагнитное излучение вызывает усиление фибриллогенеза, сочетающегося с уменьшением количества воды в ткани [13].
При этом сохраняется ритмичность процессов эпитализации и созревания соединительной ткани, которое сопровождается рассасыванием грануляции [14, 15]. Таким образом, ЭМИ на определенных частотах способствует процессам раневой констрикции, т. е. уменьшению диаметра раны. Предполагаемым механизмом действия ЭМИ, реализующим вышеописанные эффекты, является воздействие на величину зарядов и кластерную способность сферических наноструктурных образований воды в межклеточной жидкости – баблстоунов.
Данные образования способны влиять на пропускную способность ионно-обменных каналов мембран различных клеток [16]. Поэтому изучение влияния ЭМИ на течение и скорость заживления гнойных ран является актуальной задачей современной хирургии. Пандемия COVID-19 потребовала обращения к технологиям электромагнитного излучения, которые ранее эффективно применялись в мировой системе здравоохранения.
Тщательный анализ многочисленных результатов, полученных в этой области, привел исследователей к разработке технологий дистанционного подавления патогенов с низким уровнем шума. Устройство для неинвазивной электромагнитной терапии, разработанное с использованием технологии subnoise, успешно прошло рандомизированные контролируемые клинические испытания при лечении пациентов с легкой и среднетяжелой формой заболевания Sars-Cov-2 в COVID-клинике Самарского государственного медицинского университета [17]. Цель исследования – изучение влияния неинвазивной электромагнитной терапии процессов заживления гнойных ран у кроликов.
Материалы и методы
Проспективное нерандомизированное исследование проводили в условиях факультета ветеринарной медицины, зоотехники и биотехнологий ФГБОУ ВО «Дальневосточный государственный аграрный университет» в период с июня 2023 г. по декабрь 2024 г. Эксперимент проводился на 14 беспородных кроликах, возрастом 4–5 мес., средней массой 3–4 кг. Для лечения гнойных ран использовали устройство электромагнитной терапии, апробированное в COVID-клинике Самарского государственного медицинского университета. Аппарат неинвазивной электромагнитной терапии зарегистрирован в качестве медицинского изделия в Государственном реестре Федеральной службы по надзору в сфере здравоохранения Российской Федерации (№RZN 2021/15459 от 23 сентября 2021 г., регистрационное досье №RD36804/79643).
Принцип действия аппарата
Принцип действия указанного аппарата основан на слабом неионизирующем нетепловом электромагнитном излучении, непрерывно генерируемом высоковольтными импульсами вольфрамовых электродов. Частота импульсов находится в диапазоне 100–150 Гц, каждый меандроподобный волновой пакет имеет частотный режим 25 кГц. Потребляемая мощность при работе составляет 12 Вт, максимальная – 150 Вт. Напряжение на вольфрамовых электродах не превышает 8 кВ. Электромагнитное излучение, генерируемое данным аппаратом, соответствует Национальным требованиям здравоохранения Российской Федерации [17].
После проведения моделирования гнойных ран кожного покрова площадью от 4 до 5% по отношению к поверхности тела животного (площадью от 120 до 300 мм2 ) на 5-е сут. от момента инфицирования кроликов разделили на 2 группы по 7 особей в каждой. Способ моделирования гнойной раны заключается в моделировании после подготовки операционного поля, разреза мягких тканей диаметром 3,5–5,5 см по трафарету, выполненному из листа рентгеновской пленки. На область планируемого разреза маркером наносились контуры стандартной обширной раны округлой формы в межлопаточной области. По намеченному контуру под местным обезболиванием (инфильтративная анестезия 0,5%-ным новокаином) рассекалась кожа и поверхностная фасция. Затем лоскут шкурки выворачивался шерстью во внутрь раны, фиксировался повязкой, через 3–5 сут. в ране формировался гнойный процесс.
Контрольной группе животных после моделирования гнойных ран проводилась их местная обработка раствором 0,9% NaCl без использования дополнительных медикаментозных средств. Опытной группе проводилась местная обработка ран раствором 0,9% NaCl без использования дополнительных медикаментозных средств и ежедневная электромагнитная терапия – 4 сеанса по 30 мин в 8, 12, 16, 19 ч в течение дня. Продолжительность электромагнитного воздействия на опытную группу составила 14 дней. Для лечения инфицированных ран использовали оборудование, использованное в COVID-клинике Самарского государственного медицинского университета [9].
Перед моделированием гнойных ран проведен общий клинический осмотр животных и измерена температура тела. Все показатели были в пределах физиологической нормы. Непосредственная длительность данного эксперимента составила 17 дней. В обозначенный период проведена оценка интенсивности регенерации и качества заживления гнойных ран с изучением микробного пейзажа и клинический анализ крови (количество лейкоцитов, нейтрофилов, лимфоцитов, тромбоцитов). Клинический контроль производили путем регистрации температуры тела, а также местных признаков воспаления – наличия локального отека, наличия гнойного отделяемого, сроков появления грануляционной ткани.
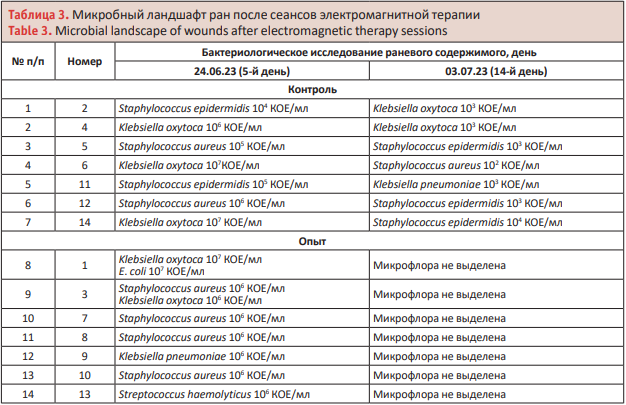
При фоновом исследовании микробиоценоза кожи кроликов выявлены монокультура Staphylococcus epidermidis – 25%, Staphylococcus saprophyticus – 25% и Pseudomonas aeruginosa – 50% случаев. Данные микроорганизмы являются постоянными обитателями кожного покрова кроликов и могут не вызывать воспалительных процессов на неповрежденной коже. Бактериологический контроль осуществлялся путем проведения качественной оценки бактериологических посевов раневого содержимого на 5, 14 и 30-е сут. после появления гнойных процессов в ране.
Оценка заживления ран проводилась планиметрическим методом [7] на 1, 4, 7, 10 и 14-е сут. Процент уменьшения раны за сутки рассчитывали по формуле: (S – Sn) x 100 / S x t, где S – величина площади раны (мм2 ) при предыдущем измерении, Sn – величина площади раны (мм2 ) при данном измерении, t – число дней между измерениями.
Для измерения площади раны на ее поверхность накладывалась стерильная полиэтиленовая пленка, через нее обводился контур раны. Затем полученное изображение раны накладывали на лист миллиметровой бумаги, после чего подсчитывали количество квадратных сантиметров и миллиметров, заключенных внутри границ контура. При проведении научных исследований придерживались требований биоэтики согласно национальным общим этическим принципам экспериментов на животных, соответствующим положениям Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей от 18 марта 1986 г.
Проведение исследования одобрено локальным этическим комитетом Дальневосточного государственного аграрного университета Российской Федерации (протокол №7 от 14.04.2024). Статистическая обработка материала Статистическую обработку результатов исследования осуществляли с помощью персонального компьютера с программами Excell 2003, SP-1 и Statistica pro Windows (версия 6). Результаты исследования были разнесены по шкале среднеарифметических значений (mean) ± стандартное отклонение (SD). Различия средних значений (p) в основных показателях послеоперационного периода оценивали с применением парного t-критерия Стьюдента, который считали достоверным при р < 0,05.
Результаты и обсуждение
Через пять дней после моделирования гнойных ран выявлено, что в контрольной группе у 14,3%, а в опытной – у 42,9% животных отмечалась гипертермия. После обработки гнойных ран животным опытной группы провели электромагнитную терапию в течение 15 мин.
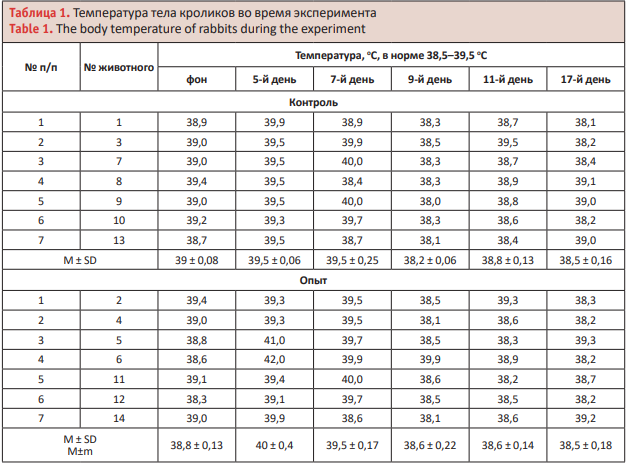
На 7-й день лечения у 57,1% кроликов обеих групп отмечена гипертермия. К 9-му дню у животных в опытной группе повышенной температуры не наблюдалось, тогда как у 14,3% кроликов в контрольной группе все еще была незначительная гипертермия. В более поздние сроки наблюдений у животных в обеих группах повышения температуры не наблюдалось (табл. 1). К 5-му дню после моделирования гнойных ран их размеры у 2 животных в обеих группах превышали первоначальную площадь на 5–10 мм2 .
На 7-й день у 4 животных (57,14%) в контрольной группе и у 5 животных (71,42%) в опытной группе выявлено уменьшение площади ран на 10 мм2 . На 9-й день у 2 кроликов (28,5%) контрольной группы границы раны расширились на 10 мм2 , у 4 кроликов (57,14%) площадь ран уменьшилась в пределах от 5 до 10 мм2 и у 1 кролика (14,3%) размеры раны оставались без изменений. У 3 (42,9%) кроликов опытной группы к 9-му дню площадь ран уменьшилась от 5 до 40 мм2 , а у 4 кроликов (57,14%) были на том же уровне, что и на 7-й день. На 11-й день у всех кроликов в контрольной группе размер ран уменьшился от 90 до 160 мм2 . Но у 5 (71,4%) кроликов в этой группе в ране было обнаружено скудное количество гнойного содержимого, процесс заживления протекал вяло, у двух животных раны был мокнущего характера, окружающие мягкие ткани были гиперемированы, отечные.
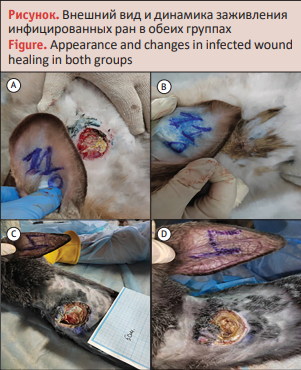
Примечание: А – экспериментальная группа, 3-й день комбинированной терапии; B – экспериментальная группа, 30-й день наблюдения; C – контрольная группа, 3-й день лечения физиологическим раствором; D – контрольная группа, 30-й день последующих мер
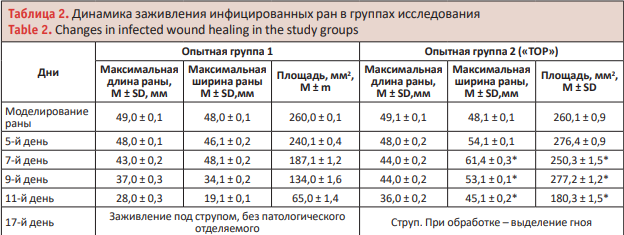
У животных опытной группы к 11-му дню процессы регенерации тканей были намного интенсивнее и лучше. У кроликов под номерами 2, 4, 6 рана почти полностью зажила и была затянута тонким слоем сухой корочки (струп). К 17-му дню у 3 кроликов (42,9%) в контрольной группе под номерами 1, 3, 7 все еще наблюдались гнойные явления при формировании струпа. У всех остальных животных раны полностью зажили (табл. 2). В опытной группе у всех кроликов раны были зажившие, гнойного содержимого не наблюдалось (рисунок).
На 5-е сут. у животных контрольной группы выделена монокультура Staphylococcus epidermidis – 28,57%, в 50% случаев – грамотрицательные бактерии Klebsiella oxytoca, в 42,86% случаев – грамположительные бактерии вида Staphylococcus aureus. В опытной группе у двух голов выявлены микробные ассоциации №1 Klebsiella oxytoca и Е. coli, №3 Staphylococcus aureus 106 КОЕ/ мл и Klebsiella oxytoca 106 КОЕ/мл. У 28,57% кроликов выделена Klebsiella oxytoca, у 57,14% – Staphylococcus aureus, а у 14,29% животных данной группы обнаружены Klebsiella pneumonia, Streptococcus haemolyticus и Е. coli.
На 14-й день эксперимента в опытной группе после проведения электромагнитной терапии по предложенной схеме лечения гнойных ран у животных микрофлора не выявлена. Микробный пейзаж контрольной группы во вторую фазу течения раневого процесса на 90% изменился и уменьшилось количество бактерий. У 37,5% кроликов в контрольной группе выявлены грамположительные бактерии Staphylococcus epidermidis и грамотрицательные бактерии Klebsiella oxytoca, в 14,29% случаев – грамположительные бактерии Staphylococcus aureus и у одного кролика (14,29%) была обнаружена грамотрицательная факультативноанаэробная капсульная бактерия Klebsiella pneumoniae.
На 30-е сут. после начала эксперимента у животных контрольной группы в 57,14% случаев выделены бактерии вида Staphylococcus epidermidis и в 14,29% случаев – Klebsiella oxytoca. У всех остальных животных (28,57%) данной группы микрофлоры не выделено. У 100% животных в опытной группы на кожном покрове и поверхности зажившей раны никакой микрофлоры не обнаружено. Кроме того у этих животных на месте зажившей раны рубцов не обнаружено, и на этом участке вырос шерстный покров (табл. 3).
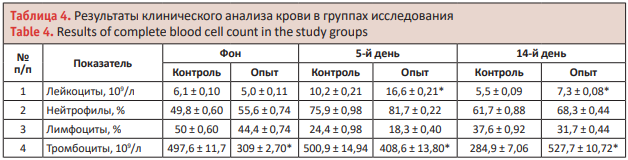
Содержание лейкоцитов в крови кроликов перед экспериментом в средних значениях находилось в пределах нормы. На 5-й день после моделирования гнойной хирургической раны количество лейкоцитов превысило верхнюю границу физиологической нормы в контрольной группе на 3,0%, в опытной группе – на 67,7%.
На 14-й день эксперимента показатели содержания лейкоцитов в крови в обеих группах были в пределах физиологической нормы, причем в контрольной группе их содержание было ниже первоначальных величин. Содержание тромбоцитов в крови кроликов на 5-й день после моделирования гнойной раны в контрольной группе возросло на 0,7%, в опытной группе – на 32,2%.
На 14-й день в контрольной группе количество тромбоцитов уменьшилось на 57,25%, тогда как в опытной группе после сеансов электромагнитной терапии тромбоцитарная активность возросла в 1,7 раза (на 70,78%) по сравнению с первоначальными величинами (табл. 4). Гипертермия характеризует выраженность первой стадии воспалительной реакции, которая сопровождается выбросом в кровь простагландинов и простациклинов, влияющих на центр терморегуляции.
Наш эксперимент показал, что в случае электромагнитной терапии первая фаза течения раневого процесса ускоряется во времени, эффективно перетекая в фазу пролиферации и ремоделирования рубца [1, 6, 18]. Гиперлейкоцитоз у большинства представителей опытной группы за счет нейтрофилов свидетельствует об интенсификации процессов элиминации бактерий и продуктов клеточно-тканевой деструкции, отграничении процессов воспаления с формированием клеточного воспалительного вала. Две последние фазы течения раневого процесса в опытной группе также ускорены во времени по сравнению с контролем ввиду усиления активности фибробластов. Процессы констрикции, интенсивно протекающие в группе, где применялась электромагнитная терапия, характеризуются гармоничным сочетанием процессов эпителизации и фибриллогенеза зрелой грануляционной ткани [6, 7]. Эффективность и сбалансированность процессов «респираторного стресса» характеризует отсутствие гнойного отделяемого опытной группы к 11-му дню эксперимента, в то время как в контрольной группе процесс нагноения еще не был полностью элиминирован, большая скорость заживления ран под воздействием электромагнитной терапии объясняется также асептическими условиями протекания регенерационных процессов второй фазы воспаления [1, 7]. Уже на 14-е сут. эксперимента роста микрофлоры на раневой поверхности в опытной группе выявлено не было, также ее не отмечалось и на 30-е сут. эксперимента, в то время как микробный раневой пейзаж контрольной группы формирует разнообразная грамположительная и грамотрицательная флора, воздействие которой ожидаемо тормозит процессы заживления [1, 3]. Интерес представляет также резкое увеличение количества тромбоцитов в опытной группе к 14-м сут. проведения эксперимента. В настоящее время общеизвестно, что тромбоциты, помимо участия в процессах свертывания крови, содержат в себе до 100 биологически активных гранул на клетку [18]. В их состав входят различные факторы роста, гистамин, серотонин, эластаза, коллагеназа, белок, предшественник амилоида. Данные вещества стимулируют неоангиогенез в молодой соединительной ткани, обладают хематаксичными свойствами в отношении лимфоцитов, макрофагов, нейтрофилов, стимулируя местный иммунитет [14].
Выводы
- Использование неинвазивной электромагнитной терапии в лечении экспериментальных гнойных ран у кроликов ускоряет процессы их заживления.
- Применение неинвазивной электромагнитной терапии является вспомогательным средством раневой регенерации и должно использоваться совместно с классическими методами ведения гнойных ран.
- Электромагнитная терапия, кроме местных эффектов, обладает системным иммуностимулирующим действием, механизм которого требует дальнейшего изучения.
Список литературы
- Heal CF, Banks JL, Lepper PD, Kontopantelis E, van Driel ML. Topical antibiotics for preventing surgical site infection in wounds healing
by primary intention. Cochrane Database Syst Rev. 2016;11(11):CD011426. https://doi.org/10.1002/14651858.CD011426.pub2. - Peel T, Astbury S, Cheng AC, Paterson D, Buising K, Spelman T et al. Multicentre randomised double-blind placebo controlled trial
of combination vancomycin and cefazolin surgical antibiotic prophylaxis: the Australian surgical antibiotic prophylaxis (ASAP) trial.
BMJ Open. 2019;9(11):e033718. https://doi.org/10.1136/bmjopen-2019-033718. - Li Y, Zhang ZB, Liu JS, Wu ZM, Sun XC, Zhao YT, Zhang XZ. Analysis of the therapeutic effect of artificial leather embedding combined
with fascial sleeve flap transplantation on chronic wounds oflower limbs with bone and plate exposure. BMC Surg. 2022;22(1):69.
https://doi.org/10.1186/s12893-022-01521-2. - Norman G, Dumville JC, Mohapatra DP, Owens GL, Crosbie EJ. Antibiotics and antiseptics for surgical wounds healing by secondary
intention. Cochrane Database Syst Rev. 2016;3(3):CD011712. https://doi.org/10.1002/14651858.CD011712.pub2. - Diao W, Li P, Jiang X, Zhou J, Yang S. Progress in copper-based materials for wound healing. Wound Repair Regen. 2024;32(3):314–322.
https://doi.org/10.1111/wrr.13122. - Аndreeva AA, Glukhov AA, Ostroushko AP, Boev SN, Laptieva AY, Grigor’eva EV et al. Simulation of Mechanical and Thermal Wounds of Soft
Tissues. Bull Exp Biol Med. 2022;173(3):287–292. https://doi.org/10.1007/s10517-022-05535-x. - Babushkina IV, Gladkova EV, Belova SV, Norkin IA. Application of Preparations Containing Copper Nanoparticles for the Treatment
of Experimental Septic Wounds. Bull Exp Biol Med. 2017;164(2):162–164. https://doi.org/10.1007/s10517-017-3948-y. - Adams B, Petruccione F. Nature’s Novel Materials: A Review of Quantum Biology. In: Chakraborty T (еd.). Encyclopedia of Condensed Matter
Physics. Academic Press: Oxford, UK; 2024. - Amini A, Pouriran R, Abdollahifar MA, Abbaszadeh HA, Ghoreishi SK, Chien S, Bayat M. Stereological and molecular studies on the
combined effects of photobiomodulation and human bone marrow mesenchymal stem cell conditioned medium on wound healing
in diabetic rats. J Photochem Photobiol B. 2018;182:42–51. https://doi.org/10.1016/j.jphotobiol.2018.03.010. - Dastgheib M, Shaddel M, Saba V, Homayouni MM, Fereydoni A. Role of magnetic Field in the Healing of Cutaneous Leishmaniasis Lesions
in Mice. Arch Razi Inst. 2020;75(2):227–232. https://doi.org/10.22092/ari.2019.123403.1246. - Li Y, Nie L, Jin S, Sun C, Lu X. The Effect of Plasma on Bacteria and Normal Cells in Infected Wound. Oxid Med Cell Longev.
2022;2022:1838202. https://doi.org/10.1155/2022/1838202. - Usselman RJ, Chavarriaga C, Castello PR, Procopio M, Ritz T, Dratz EA et al. The Quantum Biology of Reactive Oxygen Species Partitioning
Impacts Cellular Bioenergetics. Sci Rep. 2016;6:38543. https://doi.org/10.1038/srep38543. - Kouhkheil R, Fridoni M, Piryaei A, Taheri S, Chirani AS, Anarkooli IJ et al. The effect of combined pulsed wave low-level laser therapy
and mesenchymal stem cell-conditioned medium on the healing of an infected wound with methicillin-resistant Staphylococcal aureus
in diabetic rats. J Cell Biochem. 2018;119(7):5788–5797. https://doi.org/10.1002/jcb.26759. - Bagheri M, Amini A, Abdollahifar MA, Ghoreishi SK, Piryaei A, Pouriran R et al. Effects of Photobiomodulation on Degranulation
and Number of Mast Cells and Wound Strength in Skin Wound Healing of Streptozotocin-Induced Diabetic Rats. Photomed Laser Surg.
2018;36(8):415–423. https://doi.org/10.1089/pho.2018.4453. - Gurhan H, Bruzon R, Kandala S, Greenebaum B, Barnes F. Effects Induced by a Weak Static Magnetic Field of Different Intensities
on HT-1080 Fibrosarcoma Cells. Bioelectromagnetics. 2021;42(3):212–223. https://doi.org/10.1002/bem.22332. - Bunkin NF, Bolotskova PN, Bondarchuk EV, Gryaznov VG, Kozlov VA, Okuneva MA et al. Dynamics of Polymer Membrane Swelling
in Aqueous Suspension of Amino-acids with Different Isotopic Composition; Photoluminescence Spectroscopy Experiments. Polymers.
2021;13(16):2635. https://doi.org/10.3390/polym13162635. - Фатенков ОВ, Давыдкин ИЛ, Яшков АВ, Губарева ЕЮ, Комарова МВ, Бондарчук ЕВ Эффективность аппарата неинвазивной
электромагнитной терапии «ТОР» для дистанционного устранения COVID-19: результаты II фазы клинических испытаний. Вестник
Медицинского института непрерывного образования. 2024;4(4):25–34. https://doi.org/10.36107/2782-1714_2024-4-4-25-34.
Fatenkov OV, Davydkin IL, Yashkov AV, Gubareva EYu, Komarova MV, Bondarchuk EV et al. Efficacy of the TOR Non-invasive electromagnetic
Therapy Device for the Remote Treatment of COVID-19 Clearance: Phase II Clinical Trial Results. Bulletin of the Medical Institute
of Сontinuing Education. 2024;4(4):25–34. (In Russ.) https://doi.org/10.36107/2782-1714_2024-4-4-25-34. - Ploskonos MV, Zulbalaeva DF, Kurbangalieva NR, Ripp SV, Neborak EV, Blagonravov ML et al. Assessing the biological effects of microwave
irradiation on human semen in vitro and determining the role of seminal plasma polyamines in this process. Biomed Rep. 2022;16(5):38.
https://doi.org/10.3892/br.2022.1521.


 Назад
Назад


